
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是( )

A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强
B.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3 mol/L
C.d点溶液通过蒸发可以变到c点
D.a点对应的Ksp等于c点对应的Ksp
科目:高中化学 来源: 题型:
【题目】金属钒熔点高、硬度大,具有良好的可塑性和低温抗腐蚀性.工业常用钒炉渣(主要含FeO·V2O3,还有少量Al2O3、CuO等杂质)提取金属钒,流程如图:

已知:
I.钒有多种价态,其中+5价最稳定.钒在溶液中主要以VO2+和VO3-的形式存在,存在平衡:VO2++H2OVO3+2H+.
Ⅱ.部分离子的沉淀pH:
Cu2+ | Fe2+ | Fe3+ | |
开始沉淀PH | 5.2 | 7.6 | 2.7 |
完全沉淀PH | 6.4 | 9.6 | 3.7 |
回答下列问题
(1)碱浸步骤中最好选用______________(填字母)
a. NaOH溶液 b.氨水c.纯碱溶液
(2)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,其中铁元素全部转化为+3价的氧化物,写出该反应的化学方程式___________________________________
(3)溶液1到溶液2的过程中,调节pH至8有两个目的,一是除去________离子,二是促使_________.
(4)沉钒过程中得到NH4VO3沉淀需要洗涤,写出实验室洗涤的操作方法____________________.
(5)常用铝热反应法由V2O5冶炼金属钒,请写出反应的化学方程式____________________________.
(6)钒的化合物也有广泛的用途,如一种新型铝离子可充电电池的结构如图所示.
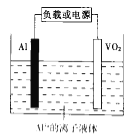
已知放电时电池反应为xAl+VO2=AlxVO2↓,则放电时正极的电极反应式为_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A. 升高温度,可能引起由c向b的变化
B. 该温度下,水的离子积常数为l.0×10-13
C. 该温度下,加入FeCl3可能引起由b向a的变化
D. 该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值,下列说法正确的是
A. 1L 1mol/L CH3COONa 溶液中含有 CH3COO-的数目为 NA
B. 100 ml 1.0 mol·L-1 FeCl3 溶液与足量 Cu 反应,转移的电子数为 0.2NA
C. 标准状况下,11.2 L CCl4 中含有 C—Cl 键的数目为 2NA
D. NA 个 D2O 分子中,含有 10NA 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4是一种补血剂,常温下久置易变黄,一般认为是二价铁被氧化为三价铁的缘故。
(1)已知:①Fe2+(aq)-e-= Fe3+(aq) △H1=akJ/mol
②O2(g)+4 e-+4H+(aq)=2H2O(l) △H2=bkJ/mol
则FeSO4在酸性溶液中变质的热化学方程式为_____ 。
常温下,配制浓度为0.1mol/L的FeSO4溶液,研究不同 pH 对Fe2+ 氧化的影响,结果如下图所示,(假设反应过程中溶液体积不变)。

(2)在pH=5.5的环境下,该反应在0~15min的平均速率v(Fe2+)=_______;增大溶液pH,Fe2+被氧化速率_______(填“增大”、“减小”或“无影响”)。
(3)在平衡常数的计算中气态物质常以压强代替其浓度,Fe2+在酸性环境下氧化的平衡常数K的计算表达式是______;常温下该反应的平衡常数很大,为2.5×1032L4 /(atmmol4),下列说法正确的是_______。
a. Fe2+转化为Fe3+的趋势大 b. Fe2+转化为Fe3+的速率大
c. 反应进行得较为彻底 d. 酸性条件下Fe2+不会被氧化
(4)在pH=13的环境下,Fe2+的氧化变质可以理解为:
第一步: Fe2++2OH-= Fe(OH)2,第二步_____________ (用化学方程式回答);当氧化达到平衡时,c(Fe2+)/ c(Fe3+)_____4.0×1022(填“>”“<”或“=”)。已知的Ksp[Fe(OH)3]=2.5×10-39,Ksp[Fe(OH)2]=1.0×10-15。
(5)根据上述分析,配制FeSO4溶液的正确方法是加入适量的铁粉和_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:

①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用木炭粉和水蒸气在高温条件下反应制取H2,同时生成CO2。某学习小组在实 验室中模拟H2的工业生产过程并测定其产率,实验装置如下所示。

(1)仪器a的名称为_______________。仪器b的作用为____________________________。
(2)实验步骤:连接好装置,检查装置的气密性;______________________(按顺序填入下列步骤的序号)。
①向装置A、B、C、D中分别加入相应试剂,打开活塞K,通入一段时间N2。
②加热装置B处硬质玻璃管。
③关闭活塞K,连接盛有适量水的量气管。
④点燃装置A处酒精灯。
⑤待装置B处木炭粉完全反应后,停止加热。
(3)装置B处硬质玻璃管中发生的所有反应的化学方程式为______________________。
(4)读取B气管读数时,应注意的事项为冷却至室温、___________、视线与凹液面最低点相切;若仰视读取初始读数,则导致所测气体的体积___________(填“偏大”或“偏小”)。
(5)实验后所域取的气体体积为V2 mL标准状况);取装置C中液体,加入足量BaCl2溶液,过滤、洗涤,将滤液和洗涤液合并,以甲基橙为指示剂,用0.1000molL-1的盐酸标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V3mL。
①达到滴定终点时的现象为____________________________________________。
②H2的产率为______________________(列出代数式即可)。
③还可通过___________,得出装置C中所吸收产物的物质的量。
(6)从安全角度考虑,该实验装置的缺陷为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。请回答下列问题:
(1)钴在元素周期表中的位置是___________,其基态原子的价电子排布图为___________。
(2)FeCO3是菱铁矿的主要成分,其中C原子的杂化方式为________;分子中的大π键可用符号Π![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为Π![]() ),则CO32-中的大π键应表示为________。
),则CO32-中的大π键应表示为________。
(3)已知Fe2+半径为61pm,Co2+半径为65pm,在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,其原因可能是______。
(4)Co(NH3)5Cl3是钴的一种配合物,向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g。则该配合物的配位数为_____。
(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构(如图所示),则该晶体中与铁原子距离最近的铁原子数目为___________;若该晶胞参数为a pm,则该晶体的密度为___________g·cm-3(阿伏加德罗常数的值用NA表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+ 4CO(g)![]() CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。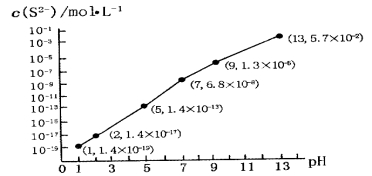
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com