
| A. | ①②④ | B. | ②③⑤ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
分析 二氧化硫为酸性氧化物,与碱反应生成盐和水;具有还原性、氧化性,结合氧化还原反应分析是否生成沉淀和气体,以此来解答.
解答 解:①二氧化硫具有还原性,与H2S反应生成S沉淀,产生了沉淀,故错误;
②亚硫酸酸性比碳酸强,可与NaHCO3反应生成气体,故错误;
③SO2能与Na2SO3溶液反应:Na2SO3+SO2+H2O=2NaHSO3,既无沉淀又无气体产生,故正确;
④发生强酸制取弱酸的反应,生成硅酸沉淀,故错误;
⑤二氧化硫具有还原性,与Ba(NO3)2发生氧化还原反应生成硫酸钡沉淀和NO气体,故错误;
⑥二氧化硫过量,生成亚硫酸氢钡,没有气体和沉淀生成,故正确;
⑦亚硫酸酸性比盐酸弱,而二氧化硫与氯化钡不反应,故正确.
故选C.
点评 本题考查二氧化硫的性质,为高频考点,把握二氧化硫为酸性氧化性、具有还原性为解答的关键,侧重氧化还原反应的考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 应用 | 解释 |
| A | 在相同条件下,在两支试管中各加入2mL 5% H2O2溶液,再向H2O2溶液中分别滴入1mL H2O和1mL 0.1mol•L-1 FeCl3溶液,对比观察现象 | 可以探究催化剂FeCl3对H2O2 分解速率的影响 |
| B | 向盛有1mL 0.01mol•L-1 AgNO3溶液的试管中滴加5滴0.01mol•L-1 NaCl溶液,有白色沉淀生成,再向其中滴加0.01mol•L-1 KI溶液,产生黄色沉淀. | 常温下,Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出 | 蛋白质均发生变性 |
| D | 保存硫酸亚铁溶液需加入少量稀盐酸和铁钉 | 防止 Fe2+水解以及被 O2 氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的HF溶液加水稀释过程中,HF的电离平衡常数逐渐增大 | |
| B. | pH=12的NaOH溶液与pH=2的醋酸溶液等体积混合后,溶液呈中性 | |
| C. | pH=5的NaHSO3溶液中水电离出的H+浓度小于10-71mol•L-1 | |
| D. | 向Na2CO3,Na2SO4的混合溶液中逐滴加入BaCl2溶液,一定先生成BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
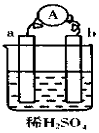
| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,外电路中,电流从b极到a极 | |
| D. | a极上发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2-的结构示意图: | |
| B. | 乙烯的比例模型: | |
| C. | 乙醛的结构简式:CH3COH | |
| D. | 含中子数为10的氧元素的一种核素${\;}_8^{18}O$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
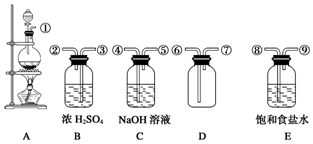
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
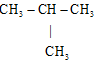 ⑤乙烷和丁烷
⑤乙烷和丁烷查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com