
实验室进行NaCl溶液蒸发时,一般有以下操作过程:①放置酒精灯②固定铁圈的位置③放上蒸发皿④加热搅拌⑤停止加热、余热蒸干。其正确的操作顺序是
A. ①②③④ B. ①②③④⑤ C. ②③①④⑤ D. ②①③④⑤
科目:高中化学 来源:2017届四川省、温江中学等五校高三上第一次联考化学卷(解析版) 题型:填空题
联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,HCN中C的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) ΔH1
②N2(g)+2H2(g)=N2H4(l) ΔH2
③O2(g)+2H2(g)=2H2O(g) ΔH3
④2N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) ΔH 4=-1048.9kJ/mol
上述反应热效应之间的关系式为ΔH4=_________,联氨和N2O4可作为火箭推进剂的主要原因为__________________。
(4)联氨为二元弱碱,在水中的电离方程式与氨相似,联氨在水中第一步电离反应的平衡常数值为______________(已知:N2H4+H+ N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为 。
N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的正盐的化学式为 。
(5)联氨是一种常用的还原剂。向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 _。联氨可用于处理高压锅炉水中的氧气,防止锅炉被腐蚀。理论上1kg的联氨可除去水中溶解的O2___________kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 _。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:填空题
酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸(H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
(1)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,写出该反应的离子方程式_______________。
(2)取300mL0.3mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是________mol。
(3)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。解释产生这两个过程的原因______________________。
(4)NaClO具有很强的氧化性,可以和Fe(NO3)3制取具有高效净水功能的Na2FeO4,写出相关的方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届山东省淄博市高三上学期第一次月考化学试卷(解析版) 题型:选择题
化学与生活、社会密切相关。下列说法正确的是
A.加碘盐的溶液遇淀粉变蓝
B.汽油和柴油均为石油分馏得到的产品
C.CaCO3可用作工业废气的脱硫剂
D.蔗糖、淀粉、蛋白质溶于水均能形成胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:填空题
23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为________, MCl2的相对分子质量为________,M的相对原子质量为________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.1mol任何气体的体积都是22.4L
B.1molH2 的质量是1g,它所占的体积是22.4L
C.在标准状况下,1mol任何物质所占的体积都约为22.4L
D.在标准状况下,1mol任何气体所占的体积都约为22.4L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是
A.1 mol N2所含有的原子数为NA
B.标准状况下,22.4 L水中含有的水分子数为NA
C.标准状况下,22.4 L氯化氢所含的原子数为NA
D.32 g O2所含的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源:2017届广东省山一高三上学期第一次统测化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法正确的是
A.5.6 g 铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.2.5mL 16mol·L-1浓硫酸与足量铜反应,转移电子数为0.04NA
C.7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA
D.常温下,5.6 g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上9月月考化学试卷(解析版) 题型:实验题
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
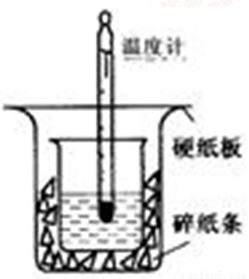
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______。装置中还存在的2个错误是 。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A盐酸的浓度 B盐酸的温度
C氢氧化钠溶液的浓度 D氢氧化钠溶液的温度
E水的比热容 F反应后混合溶液的终止温度
(3)使用补全仪器后的装置进行实验,取50ml0.50mol·L-1盐酸与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= 。
(4)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com