
9分)某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂。
请填写下列空白:
(1)酸式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入________(填“甲”或“乙”)中。
(3)用标准的盐酸滴定待测的氢氧化钠溶液时,左手握酸式滴定管的活塞,右手轻轻摇动锥形瓶,眼睛注视_______________________________________________________。
(4)直到因加入一滴盐酸后,溶液颜色由________色变为________色,并在30 s内不变,即为终点。
(5)下列操作中可能使所测氢氧化钠溶液浓度偏大的是________。
| A.酸式滴定管未用标准盐酸润洗,直接装入标准盐酸。 |
| B.酸式滴定管滴定前有气泡,滴定后气泡消失。 |
| C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥。 |
| D.读取盐酸体积开始时仰视读数,滴定结束后俯视读数。 |
9分)(1)用标准盐酸溶液润洗(2分) ;(2) 甲(1分);
(3)锥形瓶中溶液的颜色变化(2分)
(4)由黄(1分)色变为橙色(1分) ;(4)AB(2分)。
解析试题分析:(1)酸式滴定管用蒸馏水洗净后,为了洗去蒸馏水,应用标准盐酸溶液润洗2-3次;(2)用标准盐酸溶液滴定时,应将标准盐酸溶液注入酸式滴定管中;(3)滴定时,眼睛注视锥形瓶中溶液的颜色变化,当溶液由黄色变为橙色达到滴定终点;(4)甲基橙在碱性条件下呈黄色,在酸性条件下呈红色,中性色为橙色,变色范围pH为3.1-4.4;(5)A、酸式滴定管未用标准盐酸润洗,直接装入标准盐酸,标准盐酸被稀释,所用体积偏大,所测氢氧化钠浓度偏高;B、酸式滴定管滴定前有气泡,滴定后气泡消失,所读标准酸溶液的体积偏大,所测结果偏高;C、滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥,不影响滴定结果;D、读取盐酸体积开始时仰视读数,滴定结束后俯视读数,所读标准盐酸体积偏小,测定结果偏低;答案选AB。
考点:酸碱中和滴定


科目:高中化学 来源: 题型:单选题
在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
Mg2+(aq)+2OH-(aq),若使固体Mg(OH)2的量减少,而且c(Mg2+)不变,可采取的措施是:
| A.加MgCl2 | B.加H2O | C.加NaOH | D.加HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将下列物质溶于水中分别配制成0.1 mol?L—1溶液,所得溶液pH大于7的是
| A.NaCl | B.HCl | C.NaOH | D.CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
10分)某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:
①需配制0.1 mol?L-1的盐酸和0.1mol?L-1的氢氧化钠溶液;
②每次取一粒(药片质量均相同)0.2g的此胃药片,磨碎后加入20.00mL蒸馏水;
③以酚酞为指示剂,用0.1mol?L-1的氢氧化钠溶液滴定,需用去VmL达滴定终点;
④加入25.00mL0.1mol?L-1的盐酸溶液。
(1)写出实验过程中第一次滴定①-④的编号顺序______________。
(2)下图所示的仪器中配制0.1mol?L-1盐酸和0.1mol?L-1氢氧化钠溶液肯定不需要的仪器是(填序号)_________,配制上述溶液还需要的玻璃仪器是(填仪器名称)__________。
(3)配制上述溶液应选用的容量瓶的规格是(重复滴定一次)__________________。
| A.50mL、50mL | B.100mL、100mL |
| C.100mL、150mL | D.250mL、250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(11分)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,请填写下列空白:(1)选用的指示剂是 。
(2)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________________。
(3)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________。
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
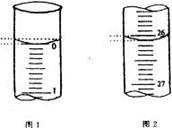
| 滴定次数 | 待测氢氧化钠溶液的体积/ mL | 0.1000 mol/L 盐酸的体积/ mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/ mL | ||
| 第一次 | 25.00 | | | |
| 第二次 | 25.00 | 2.00 | 28.08 | 26.08 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
(8分)苯甲酸及其钠盐可用作乳胶、牙膏、果酱或其它食品的抑菌剂,也可广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,制备流程为:
操作步骤如下:① 将一定量的甲苯和碱性KMnO4溶液加热至沸腾,并冷凝回流至混合液不再分层。② 反应停止后,将反应混合液过滤,滤渣为黑色固体;得到的滤液如果呈紫色,可加入少量的饱和亚硫酸钠溶液使紫色褪去,重新过滤。③ 将②中所得滤液经一系列操作得到苯甲酸晶体。
已知:苯甲酸相对分子质量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;
(1)该实验合成苯甲酸钾可能用到的下列仪器有__________。
A.圆底烧瓶 B.蒸馏烧瓶 C.冷凝管 D.温度计
(2)第①步中被回流的主要物质是____________________。
(3)写出滴加饱和亚硫酸钠溶液时的离子方程式______________________________。
(4)步骤③得到苯甲酸晶体应进行操作是________(按操作顺序填正确答案序号)。
A.酸化 B.过滤 C.蒸发浓缩 D.冷却结晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com