
| 1 |
| 2 |
| A、负极,被氧化 |
| B、负极,被还原 |
| C、正极,被氧化 |
| D、正极,被还原 |
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
| A、CH4和C3H8 |
| B、CH4和C3H4 |
| C、C2H6和C3H4 |
| D、C2H2和C2H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
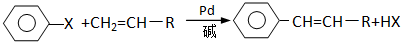 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)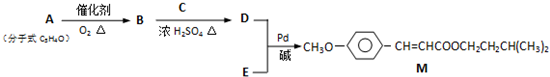
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验 | 操作 |
| A | 氨气的收集和检验 | 用向上排空气法收集氨气,并用干燥的红色石蕊试纸放在集气瓶口检验氨气是否收集满 |
| B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000ml的容量瓶中,加水溶解,振荡摇匀,定容 |
| C | 制备Fe(OH)3胶体 | 将FeCl3固体小心加入沸水中 |
| D | 取出分液漏斗中所需的上层液体 | 从分液漏斗下端管口放出下层液体,关闭活塞,换一个接收容器,从分液漏斗上端口倒出所需液体 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入药品的顺序为Na2CO3、NaOH、BaCl2和盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在空气中受热分解制无水MgCl2 |
| C、在第③④⑤步中溴元素均被氧化 |
| D、由海水提取的金属镁能与金属铝、氢氧化钠溶液在一定条件下形成原电池,金属镁作该原电池正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
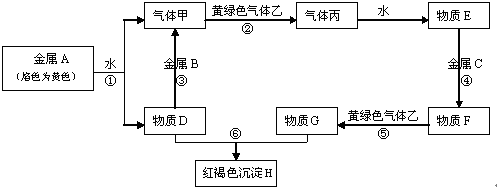
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com