

 已知:
已知:

 +Cl2
+Cl2| 铁粉 |
 +HCl,
+HCl, +Cl2
+Cl2| 铁粉 |
 +HCl;
+HCl; ,
, ;
; ,
, ;
;


 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 转变成
转变成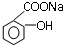 的方法是( )
的方法是( )| A、加入足量的NaOH(aq)并加热 |
| B、与足量NaOH(aq)共热后,通入足量CO2 |
| C、与盐酸共热后,加入足量的NaOH(aq) |
| D、与稀硫酸共热后,加入足量Na2CO3 (aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:

 (用反应流程图表示,无机试剂任选,并注明反应条件).
(用反应流程图表示,无机试剂任选,并注明反应条件).
| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:


 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件: 试写出只用1,3-丁二烯合成六元环化合物的结构简式
试写出只用1,3-丁二烯合成六元环化合物的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:

| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 微溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、SO42-、NO3-、Cl- |
| B、Fe2+、H+、Br-、NO3-、Cl- |
| C、Ca2+、K+、OH-、Cl-、NO3- |
| D、Al3+、Na+、Cl-、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com