
有总物质的量一定的甲烷和某有机物A(分子式为CaHbOc,a≥1、c≥1、b为正整数)的混合物。
(1)若混合物中甲烷和A不论以何种比例混合,其完全燃烧所生成的水的物质的量不变,则A的组成必须满足的条件是 ;符合此条件的A中,相对分子质量最小的A的分子式为 。
(2) 若混合物中甲烷和A不论以何种比例混合,其完全燃烧所消耗的氧气和生成的水的物质的量均不变,符合此条件的A中,相对分子质量最小的A的分子式为 。
(3) 若有机物CxHy(x、y为正整数)和CaHbOc(a≥x)不论以何种比例混合,只要混合物的总物质的量一定,完全燃烧时所消耗的氧气和生成的水的物质的量均不变,那么,这两种有机物的组成必须满足的条件是(用含x、y、a、b、c等的代数式表示)
。
科目:高中化学 来源: 题型:
 如图,有甲、乙两容器,甲体积可变,压强不变,乙保持体积不变.向两容器中分别充入1mol A,3mol B,此时两容器体积均为0.5L,温度为T℃,保持温度不变发生反应:A(g)+3B(g)?xC(g)+2D(s),乙容器中反应经4min后测得n(A)=0.5mol,v(c)=0.5mol?L-1?min-1.
如图,有甲、乙两容器,甲体积可变,压强不变,乙保持体积不变.向两容器中分别充入1mol A,3mol B,此时两容器体积均为0.5L,温度为T℃,保持温度不变发生反应:A(g)+3B(g)?xC(g)+2D(s),乙容器中反应经4min后测得n(A)=0.5mol,v(c)=0.5mol?L-1?min-1.查看答案和解析>>
科目:高中化学 来源: 题型:
 (2010?柳州三模)A、B、C、D是由前18号元素组成的四种常见化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图反应关系:
(2010?柳州三模)A、B、C、D是由前18号元素组成的四种常见化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图反应关系:| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
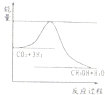
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省德州市乐陵一中高二(上)期中化学试卷(解析版) 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省徐州市高三(上)期中化学试卷(解析版) 题型:解答题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mo1/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/moI/L | 0.010 | 0.010 | 0.020 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com