
��10�֣���1 mol������һ������HCl����2L���ܱ������У�420��ʱ���ڴ��������·�����Ӧ��4HCl+O2 ![]() 2Cl2+2H2O��5���Ӻ�Ӧ�ﵽƽ�⣬�������еĻ������ͨ������NaOH��Һ������NaOH 2.0 mol���ٽ�ʣ����������ͨ������ûʳ����ļ�����Һ����O2����Һ����19.2 g��
2Cl2+2H2O��5���Ӻ�Ӧ�ﵽƽ�⣬�������еĻ������ͨ������NaOH��Һ������NaOH 2.0 mol���ٽ�ʣ����������ͨ������ûʳ����ļ�����Һ����O2����Һ����19.2 g��
��ش��������⣺
��1��д��ƽ��ʱ���������ͨ��NaOH��Һ����������Ӧ�����ӷ���ʽ��
��2������0~5����ʱ��Cl2��ƽ�����������Ƕ��١�
��3������ƽ��ʱHCl��ת���ʡ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
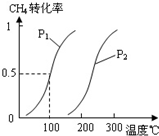 A��B��C��D��E��W��Ϊ������Ԫ�أ�ԭ�������������ش��������⣺
A��B��C��D��E��W��Ϊ������Ԫ�أ�ԭ�������������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ�䣨min�� | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 | 55 |
| SO3 Ũ�ȣ�mol/L�� |
0 | 0.1 | 0.15 | 0.20 | 0.25 | 0.30 | 0.35 | 0.40 | 0.50 | 0.55 | 0.60 | 0.60 |
| ʱ�䣨min�� | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3Ũ�ȣ�mol/L�� | 0 | 0.2 | 0.30 | 0.40 | 0.50 | 0.50 |
| ʱ�䣨min�� | 0 | 5 | 10 | 15 | 20 | 25 |
| SO3Ũ�ȣ�mol/L�� | 0 | 0.25 | 0.35 | 0.35 | 0.35 | 0.35 |
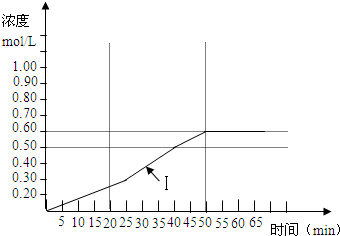
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ�����и�һ��ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ�ũҵ������������������Ҫ���á���ش��������⣺
��1����ͼ1��1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ��ͼ���漰���ʾ�Ϊ��̬������д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ����������
��2����0.5L���ܱ������У�����һ�����ĵ������������з�Ӧ��������������ʵ�����ʱ��ı仯������ͼ2��ʾ����Y������������2min��N2�ķ�Ӧ���ʦ�(N2)=����������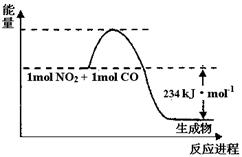 ������
������
����ͼ1������������������������������������ͼ2
��3�����Ṥҵ�ڹ��á�������ҵ�ͺ�����ҵ��ռ����Ҫ��λ�����Ż�ѧ��ά�������л��ϳɡ�����������ȹ�ҵ��Ѹ�ٷ�չ����Ҫʹ�ô��������ᡣ
�ٹ�ҵ�������ò�ϵ������Ϊ�������ð���������ȡ���ᡣ��һ����ӦΪ���ڴ���������������������Ӧ����NO��д����Ӧ��ѧ����ʽ����������
��ͭ������ϡ���ᷴӦ��Ҳ����Ũ���ᷴӦ����ͭ��һ��Ũ�����ᷴӦʱ���ɽ�����ʽ��ʾΪ��Cu+HNO3 ��Cu(NO3)2+NO��+NO2��+H2O ������ʽδ��ƽ������Ӧ�л�ԭ����������������0.6mol Cu��������ȫ�ܽ������õ���NO��NO2���ʵ�����ͬ����õ���״�����������Ϊ��������L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ������ʡ�����и���ģ�⿼�������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
(17��)I����ҵ����һ����CO2�������״�ȼ�ϵķ�����
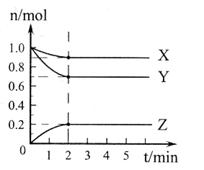
��6 mol CO2��8 mol H2����2 L���ܱ������У����H2�����ʵ�����ʱ��仯����ͼ��ʾ(ʵ��)��ͼ������a(1��6)��ʾ����1 minʱH2�����ʵ�����6 mol��

��1��a������Ӧ���� (����ڡ������ڡ���С�ڡ�)�淴Ӧ���ʡ��仯ѧƽ�ⳣ��K=
(2)����ʱ���ƽ����Ӧ���������� ��
A��O��1 min B��1��3 min C��3��8 min D��8��11 min
(3)���ı�ijһʵ�������ٽ�������ʵ����H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� �����ߢ��Ӧ��ʵ�������ı��� ����������ٳ���3molCO2��4 mol H2,H2O(g)��������� ����������䡱��С����
��ijʵ��С����̽�� ��Ӧ�������¶ȵĹ�ϵ,����1mol��L��KI��Һ��0��1mol��L��H2S04��Һ��������Һ����ʵ��ʱ�⼸���Լ��ļ���˳��Ϊ��KI��Һ�� �� ��
��Ӧ�ķ���ʽΪ
��. ������Ʒ�к�Fe��Zn��Ag��Cu�����ֽ������ʣ�Ϊ��øߴ��ȵ�����ij��ȤС��ͬѧ����Ǧ����Ϊ��Դ��������ʯīΪ�缫�������������Һ�Դ��������ᴿ��
(1)�������������������ij������У���Ҫ�Ľ�������Ϊ (�ѧʽ)��

(2) ������ͼ��ʾ���Ӷ�Ǧ���ؽ��г�硣���һ��ʱ�������A�缫������ (�ѧʽ)��B�缫�ϵĵ缫��ӦʽΪ �������ϡ�Ǧ���ص������� ��(�A����B��)��
(3)���ü���ȼ�ϵ��Ϊ��Դ����25�桢101 kPaʱ����CH4��������ֱ��ȼ������1 molˮ��������401 kJ����l gˮ����ת����Һ̬ˮ����2��445 kJ����CH4��ȼ����Ϊ (ȡ����)kJ��mol-��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com