
【题目】下列关于原子结构及微粒间的数量关系的说法不正确的是
A. 同种元素的原子均有相同的质子数和中子数
B. 微粒Na+、Mg2+、O2-具有相同的电子层结构
C. 13Al3+的核外电子数为10
D. 核外电子排布相同的微粒化学性质可能相同
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种化工原料,有如下有关信息:
常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气.
氯化法是合成硫酰氯的常用方法,实验室合成反应和实验装置如图1:
回答下列问题:
(1)仪器A的名称为 , 甲中活性炭的作用是 , B中加入的药品是 . 实验时从仪器C中放出溶液的操作方法是 .
(2)装置丁中发生反应的离子方程式为 . 用亚硫酸钠固体和浓硫酸制备二氧化硫气体时,如要控制反应速度,图2中可选用的发生装置是(填写字母).
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为 , 分离产物的方法是 .
(4)若缺少装置乙,氯气和二氧化硫可能发生反应的化学方程式为 . 为提高本实验中硫酰氯的产率,在实验操作中还需要注意的事项有(只答一条即可) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知如下氧化还原反应2BrO ![]() +Cl2=Br2+2ClO
+Cl2=Br2+2ClO ![]() 5Cl2+I2+6H2O=2HIO3+10HCl ClO
5Cl2+I2+6H2O=2HIO3+10HCl ClO ![]() +5Cl﹣+6H+=3Cl2+3H2O 则下列各微粒氧化能力强弱顺序正确的是( )
+5Cl﹣+6H+=3Cl2+3H2O 则下列各微粒氧化能力强弱顺序正确的是( )
A.ClO ![]() >BrO
>BrO ![]() >IO
>IO ![]() >Cl2
>Cl2
B.BrO ![]() >Cl2>ClO
>Cl2>ClO ![]() >IO
>IO ![]()
C.BrO ![]() >ClO
>ClO ![]() >Cl2>IO
>Cl2>IO ![]()
D.Cl2>BrO ![]() >ClO
>ClO ![]() >IO
>IO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去混在乙烷中的少量乙烯的方法是
A.将混合气体通过盛有溴水的洗气瓶B.将混合气体与HCl加成
C.将混合气与H2加成D.将混合气体与氯气混合光照
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去氯化镁酸性溶液中的Fe3+,可以在加热搅拌的条件下加入一种过量的试剂,过滤后再加入适量的盐酸。这种试剂是( )
A. 氨水 B. 氢氧化钠 C. 碳酸钠 D. 碳酸镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某羧酸衍生物A,其分子式为C6H12O2,实验表明A和氢氧化钠溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化和加热的条件下氧化为E,其中D、E都不能发生银镜反应。由此判断A的可能的结构有
A. 2种 B. 3种 C. 4种 D. 5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各化合物中,能发生酯化、加成、消去、氧化、还原五种反应的是( )
A.CH3﹣CH═CH﹣CHO
B.![]()
C.HOCH2﹣CH2﹣CH═CH﹣CHO
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫、碳的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
(1)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1△H1<0 (Ⅰ)
2NO(g)+Cl2(g)2ClNO(g) K2△H2<0 (Ⅱ)
4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=(用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应(II)达到平衡.测得10min内v(ClNO)=7.5×10﹣3molL﹣1min﹣1 , NO的转化率α1= . 其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2α1(填“>”“<”或“=”).
(3)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题.某研究小组在实验室以Ag﹣ZSM﹣5为催化剂,测得NO转化为N2的转化率随温度变化的情况如图1.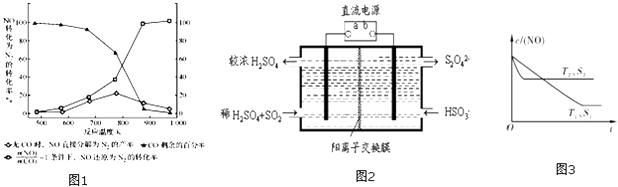
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为;在 ![]() =1的条件下,应控制的最佳温度在左右.
=1的条件下,应控制的最佳温度在左右.
②NO2尾气常用NaOH溶液吸收,生成NaNO3和 NaNO2 . 已知NO2﹣的水解常数K=2×10﹣11molL﹣1 , 常温下某NaNO2和 HNO2 混合溶液的PH为5,则混合溶液中c(NO2﹣)和c(HNO2)的比值为
(4)利用图2所示装置(电极均为惰性电极)也可吸收SO2 , 并用阴极排出的溶液吸收NO2 . 阳极的电极反应式为在碱性条件下,用阴极排出的溶液吸收NO2 , 使其转化为无害气体,同时有SO42﹣生成.该反应的离子方程式为
(5)消除汽车尾气,可以通过反应2NO(g)+2CO(g)2CO2(g)+N2(g).当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图3表示在其他条件不变时,NO的浓度c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线.①该反应的△H(填“>”或“<”)0.
②若催化剂的表面积S1>S2 , 在右图中画出c(NO)在T1、S2条件下达到平衡过程中的变化曲线(并作相应标注).
(6)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀.查阅资料得知常温下BaSO3的KSP为5.48×10﹣7 , 饱和亚硫酸中c(SO32﹣)=6.3×10﹣8 molL﹣1 . 将0.1molL﹣1的BaCl2溶液滴入饱和亚硫酸中,(填“能”或“不能”)生成BaSO3沉淀,原因是(请写出必要的推断过程).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com