
| A. | CO2的电子式 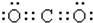 | |
| B. | Cl-的结构示意图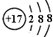 | |
| C. | NaOH的电子式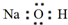 | |
| D. | 原子核内有20个中子的氯原子${\;}_{17}^{37}$Cl |
分析 A.二氧化碳分子中含有两个碳氧双键,C、O原子最外层都满足8电子稳定结构;
B.氯离子的核电荷数为17,最外层满足8电子稳定结构;
C.氢氧化钠为离子化合物,电子式中需要标出阴阳离子所带电荷;
D.质量数=质子数+中子数,元素符号的左上角为质量数、左下角为质子数.
解答 解:A.CO2为共价化合物,其分子中含有两个碳氧双键,其电子式为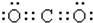 ,故A正确;
,故A正确;
B.Cl-的核外电子总数为18,氯离子结构示意图为: ,故B正确;
,故B正确;
C.氢氧化钠属于离子化合物,钠离子直接用离子符号表示,氢氧根离子除了标出所带电荷,还需要写出O、H的最外层电子,氢氧化钠的电子式为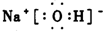 ,故C错误;
,故C错误;
D.原子核内有20个中子的氯原子的质量数为37,该原子的表示方法为:${\;}_{17}^{37}$Cl,故D正确;
故选C.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、元素符号、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的灵活应用能力.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 铝热剂 | B. | 黑火药 | C. | 木炭 | D. | 丹药(硫化汞) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
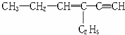 ,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数为b,在同一平面上的碳原子数最多为c,则a、b、c分别为( )| A. | 4,3,6 | B. | 4,3,8 | C. | 2,5,4 | D. | 4,4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯原子的结构示意图: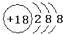 | |
| B. | HClO的结构式为:H-Cl-O | |
| C. | 氯化镁的电子式: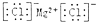 | |
| D. | 用电子式表示氯化氢分子的形成过程:H•+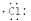 →H+ →H+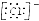 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
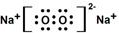 ,该物质所含有的微粒间作用力的类型为离子键、共价键.
,该物质所含有的微粒间作用力的类型为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下可用铁制容器来盛装浓硫酸、说明常温下铁与浓硫酸不反应 | |
| B. | 同一元素的各种同位素的物理性质不同、化学性质相同 | |
| C. | 金属元素的原子只有还原性,离子只有氧化性 | |
| D. | 取碘水于试管中,加入汽油振荡后静置,其现象为下层呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
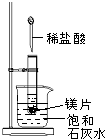 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
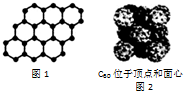
| A. | SiO2晶体中最小环上的原子数为6 | |
| B. | 在晶体中只要有阳离子就一定有阴离子 | |
| C. | 12g石墨烯(如图1)中含有六元环的个数为0.5NA | |
| D. | 720g C60晶体(如图2)中含有0.5NA个晶胞结构单元 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com