
| A. | 向Na2SiO3溶液中通入过量的CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- | |
| B. | 常温下,铁和稀硝酸反应:2Fe+6HNO3═2Fe(NO3)3+3H2↑ | |
| C. | 碳酸氢钠和过量稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 铜和浓硫酸加热反应:Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O |
分析 A.碳酸的酸性强于硅酸,能够制取硅酸;
B.不符合反应客观事实;
C.碳酸氢根离子为弱酸的酸式根离子,不能拆;
D.浓硫酸不能拆.
解答 解:A.向Na2SiO3溶液中通入过量的CO2,反应生成硅酸和碳酸氢钠,离子方程式:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故A正确;
B.硝酸具有强氧化性,与金属反应不生成氢气,故B错误;
C.碳酸氢钠和过量稀盐酸反应,离子方程式:HCO3-+H+═H2O+CO2↑,故C错误;
D.铜和浓硫酸加热反应,离子方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Cu2++SO2↑+2H2O+SO42-,故D错误;
故选:A.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意反应物用量对反应的影响,注意硝酸的强氧化性,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲一定是烷烃 | |
| B. | 乙的物质的量为0.05mol | |
| C. | 符合条件的乙的可能结构有3种(包含顺反异构) | |
| D. | 甲的质量为2.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
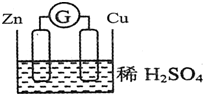 请观察如图装置,回答下列问题:
请观察如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CuCl2、Cu(NO3)2、Ba(OH)2 | B. | Al、Fe、CuSO4 | ||
| C. | MgSO4、Mg(NO3)2、Ba(OH)2 | D. | Al、Cu、FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉有效成分的化学式:Ca(ClO)2 | |
| B. | 亚硫酸的电离方程式:H2SO3═2H++SO32- | |
| C. | NO、NO2都是酸性氧化物 | |
| D. | Na+的结构示意图: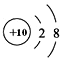 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | n=$\frac{{M}_{2}-2{M}_{1}}{58}$ | B. | n=$\frac{{M}_{2}-{M}_{1}}{29}$ | C. | n=$\frac{2{M}_{2}-{M}_{1}}{58}$ | D. | n=$\frac{{M}_{2}-{M}_{1}}{58}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
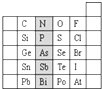 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.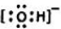 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中加入铝粉来制备H2:Al+2OH-+2H2O═AlO2-+3H2↑ | |
| B. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 实验室用氢氧化钠溶液吸收Cl2:Cl2+OH-═Cl-+ClO-+H2O | |
| D. | 用胃舒平治疗胃酸过多:Al(OH)3+3H+═Al3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com