
【题目】用图甲所示装置进行实验,若图乙中横坐标x表示流入电极的电子的物质的量.下列叙述错误的是( ) 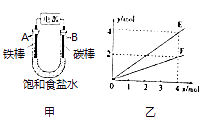
A.E表示反应生成NaOH的物质的量
B.E表示反应消耗H2O的物质的量
C.F表示反应生成H2或Cl2的物质的量
D.F表示反应消耗NaCl的物质的量
【答案】D
【解析】解:A.阴极发生反应:2H2O﹣2e﹣=H2↑+2OH﹣ , 转移4mol电子生成4mol NaOH,E可以表示反应生成NaOH的物质的量,故A正确;B.阴极发生反应:2H2O﹣2e﹣=H2↑+2OH﹣ , 转移4mol电子消耗水为4mol,E可以表示反应消耗H2O的物质的量,故B正确;
C.若Fe棒为阴极,碳棒为阳极,阳极发生反应:2Cl﹣﹣2e﹣=Cl2↑,阴极发生反应:2H2O﹣2e﹣=H2↑+2OH﹣ , 转移4mol电子,可以生成2molH2或Cl2 , F可以表示反应生成H2或Cl2的物质的量,故C正确;
D.若Fe棒为阴极,碳棒为阳极,电解池总反应式为:2NaCl+2H2O ![]() =Cl2↑+H2↑+2NaOH,转移4mol电子时有4mol NaCl参加反应,故D错误,
=Cl2↑+H2↑+2NaOH,转移4mol电子时有4mol NaCl参加反应,故D错误,
故选:D.


科目:高中化学 来源: 题型:
【题目】实验室用固体NaOH配制0.1mol/L的NaOH溶液500mL,有以下仪器:
a.烧杯 b.1000mL容量瓶 c.500mL容量瓶 d.玻璃棒 e.托盘天平 f.100mL量筒
(1)配制时,必须使用的仪器有(填字母序号),还缺少的仪器是 .
(2)该实验两次用到玻璃棒,其作用分别是、 .
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却.其正确的操作顺序是 .
(4)若使用密度为1.8g/mL、质量分数为98%的浓硫酸,配制1000mL0.18mol/L的稀硫酸,则需浓硫酸的体积是 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可用来鉴别乙烯和甲烷,又可用来除去甲烷中混有的乙烯的方法是 ( C )
A. 点燃 B. 催化加氢
C. 慢慢地通入溴水中 D. 慢慢地通入酸性高锰酸钾溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
C2H5OH(g)+3H2O(g) △H =-173.6 kJ/mol
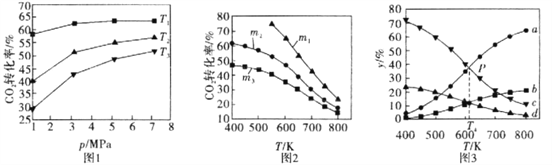
(1)图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=![]() 。
。
①图l中投料比相同,温度从高到低的顺序为________。
②图2中.m1、m2、m3投料比从大到小的顺序为________,理由是________。
(2)图3表示在总压为5MPa的恒压条件下,且m=3时,不同温度下各物质的物质的量分数与温度的关系。
①曲线b代表的物质为________(填化学式)。
②图3中P点时。CO2的转化率为________。
③T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在高温条件下可发生分解:2CH4→C2H2+3H2 , 现使甲烷分解得到的混合物的气体对氦的相对密度为2.5,则甲烷的分解率是( )
A.50%
B.60%
C.70%
D.80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如图: ![]()
下列化合物中,经过烯烃复分解反应可以生成  的是( )
的是( )
A.
B.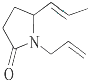
C.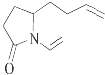
D.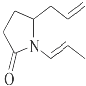
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷单质及其化合物有广泛应用.
(1)磷酸二氢钙,广泛用于动物的饲料添加剂.目前其制备的新工艺方法有:石灰法:用石灰石中和磷酸,控制终点pH为3.2,既得磷酸二氢钙.请写出该反应的化学方程式;若有1×103kg石灰石最多能生产kg磷酸二氢钙.
(2)用石英、焦炭与磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的化学方程式为:4Ca5(PO4)3F+21SiO2+30C=3P4+20CaSiO3+30CO↑+SiF4↑:在此反应中,副产物矿渣可用来 .
(3)三聚磷酸可视为三个磷酸分子(磷酸结构简式如图 ![]() )之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
)之间脱去两个水分子的产物,其结构简式为 . 三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 .
(4)次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2﹣ , 在酸性条件下发生下述反应:请配平该反应离子方程式Ni2++H2PO2﹣+═Ni++H2PO3﹣+ .
(5)H3PO2可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):①写出阳极的电极反应式 .
②分析产品室可得到H3PO2的原 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R知某温度电离平衡常数为K.该温度下向20mL 0.1mol/L CH3COOH溶液中逐滴加入01mol/L NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中正确的是( ) 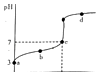
A.a点表示溶液中c(CH3COO﹣)﹣定为10﹣3 mol/L
B.b点表示的溶液中c(Na+)<c(CH3COO﹣)
C.c点表示CH3COOH和NaOH恰好反应完全
D.d点表示的溶液中 ![]() 大于K
大于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mLNa2CO3和Na2SO4的混合溶液中加入足量的氯化钡溶液,生成沉淀的质量为6.27g,向所得沉淀中加入足量稀盐酸,沉淀质量减少到2.33g,并放出气体,试计算:
(1)原混合物中Na2SO4的物质的量浓度;
(2)在标准状况下产生气体的体积.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com