
【题目】能源、资源问题是当前人类社会面临的一项重大课题。
(1)燃料电池将能量转化效率比直接燃烧效率高,如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。
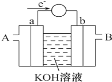
使用时,空气从_______口通入(填“A”或“B”);
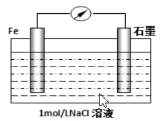
(2)钢铁的腐蚀现象非常普遍,电化学腐蚀是造成钢铁腐蚀的主要原因,某同学按下图进行钢铁腐蚀的模拟,则正极的电极反应式为:_________________,当导线中有3.01×1023个电子流过,被腐蚀的铁元素为_______g。[ 提示:电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2 ]
(3)海水化学资源的开发利用具有重要的意义和作用,下图是海带中提取碘的示意图:
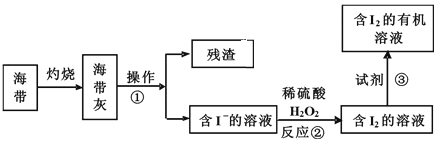
①中操作的名称是_______;下述物质中不可做试剂③的是________。
A.乙醇 B.苯 C.乙酸 D.四氯化碳
【答案】 B 2H2O + O2 + 4e- = 4OH- 14 溶解、过滤 AC
【解析】(1)由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气;
(2)钢铁腐蚀,在电解质溶液为中性溶液水膜时发生的是吸氧腐蚀,铁做负极失电子发生氧化反应,杂质碳做正极,溶液中氧气得到电子发生还原反应,结合电子守恒计算;
(3)分离不溶性固体和溶液的方法是溶解、过滤,碘离子和双氧水发生氧化还原反应生成碘单质和水,根据萃取剂的选取标准判断。
(1)由电子转移方向可知a为负极,发生氧化反应,应通入燃料,b为正极,发生还原反应,应通入空气,故答案为:B;
(2)钢铁腐蚀,在电解质溶液为中性溶液时发生的是吸氧腐蚀,铁做负极失电子发生氧化反应,电极反应为:Fe-2e-=Fe2+,杂质碳做正极,溶液中氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e-=4OH-,电化学的总反应式为2Fe+2H2O+O2=2Fe(OH)2,当导线中有3.01×1023个电子流过,电子物质的量=![]() =0.5mol,被腐蚀的铁元素为0.25mol,质量=0.25mol×56g/mol=14g,故答案为:O2+2H2O+4e-=4OH-;14;
=0.5mol,被腐蚀的铁元素为0.25mol,质量=0.25mol×56g/mol=14g,故答案为:O2+2H2O+4e-=4OH-;14;
(3)分离不溶性固体和溶液的方法是溶解、过滤,碘离子和双氧水发生氧化还原反应生成碘单质和水,离子方程式为:H2O2+2I-+2H+=2H2O+I2,萃取剂的选取标准为:溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,两种溶剂不能互溶,萃取剂和溶质不反应,乙醇和乙酸能与水互溶,所以不能作萃取剂,苯和四氯化碳符合萃取剂的选取标准,所以可以作萃取剂,故选AC,故答案为:溶解、过滤;AC。


科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族。C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍。试回答:
(1)这四种元素分别是:A________,B________,C________,D________。(填名称)
(2)这四种元素中在常温常压下的液态或气态氢化物的稳定性由大而小的顺序是____________。
(3)A与B形成的三原子分子的电子式是________, B与D形成原子个数比为1∶1的化合物的电子式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | 97 | 64.7 | 与水互溶 |
水合肼 (N2H4H2O) | 51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | 17 | 12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________;步骤Ⅱ中生成NaN3的化学方程式为______________________。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):

①仪器a的名称为____________,作用是_________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________。(合理给分)
③图中X处连接的最合适装置应为下图中的_________。

(3)步骤Ⅱ中制备叠氮化钠的操作是_______;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________。下列操作合理的是______。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COONa溶于水电离得到的__________(填“CH3COO-”或“Na+”)结合水电离产生的______(填“OH-”或“H+”)使水的电离平衡向____(填“正向”或“逆向”)移动,使体系中c(H+)___c(OH-)(填“>”或“<”),使体系呈___(填“酸”或“碱”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。放电时的电池反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据此反应判断下列说法正确的是:
A. PbO2是电池的负极 B. 电池放电时,溶液的酸性增强
C. PbO2得电子,被氧化 D. 负极电极反应式:Pb-2e- + SO42- = PbSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C3H7Br的有机物甲在适宜的条件下能发生如下一系列转化:
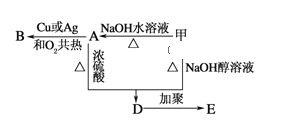
(1)若B能发生银镜反应,试回答下列问题.
①有机物甲的结构简式为_____;
②用化学方程式表示下列转化过程:
甲→A:___________________
B和银氨溶液反应:_________
(2)若B不能发生银镜反应,请回答下列问题:
①A的结构简式为__________;
②用化学方程式表示下列转化过程.甲+NaOH![]() D:_____,D→E:_____.
D:_____,D→E:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】俄罗斯科学家用铪和钨两种核素精确确定了地球和月球的年龄,得出月球至少比地球早700万年形成,它们是根据18272Hf(铪-182)和18274W(钨-182)两种核素的含量比例得出的。下列有关铪-182和钨-182的关系说法正确的是( )
A. 中子数相等 B. 互为同位素
C. 原子质量几乎相同 D. 在周期表中处于相邻位置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com