
【题目】对机动车尾气中的N元素、C 元素进行处理,可以保护环境,减少污染。
(1)汽缸中生成 NO 的反应为:N2(g)+O2(g) ![]() 2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
2NO(g) △H>0,NOx在铑(Rh)的催化下最终转化为无毒的产物,其中NO与CO的反应过程中经历如下两步(已知:1kcal=4.18kJ):
反应Ⅰ:NO(g)+CO(g)+Rh(s)![]() RhN(s)+CO2(g) △H=-8kcal·mol-1
RhN(s)+CO2(g) △H=-8kcal·mol-1
反应Ⅱ:RhN(s)+NO(g)![]() Rh(s)+N2O(g) △H =-76.4kcal·mol-1
Rh(s)+N2O(g) △H =-76.4kcal·mol-1
则由NO生成1mol N2O的△H =____kcal·mol-1。若Ⅰ比Ⅱ的反应速率大,下列能正确表示反应2NO(g)+CO(g)![]() N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____
N2O(g)+CO2(g) △H在有催化剂(a)和无催化剂(b)时反应进程的能量变化图的是_____

⑵在体积为1L的恒温密闭容器中,发生反应:
2NO(g)+2CO (g) ![]() N2(g)+2CO2(g),有关物质的量如下表:
N2(g)+2CO2(g),有关物质的量如下表:
起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 |
0.2 | 0.2 | 0 | 0 | a |
①上述反应的化学平衡常数表达式K=__________
②若达到平衡后气体的压强为开始时的0.875倍,则a =______
⑶汽车使用乙醇汽油并不能减少NOx的排放,某研究小组在实验室以耐高温试剂Ag-ZSW-5催化,测得NO转化为N2的转化率随温度变化情况如下图所示。
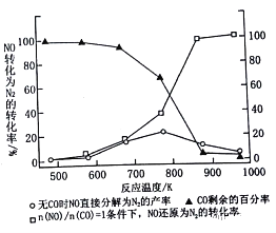
①在n(NO)/n(CO)=1条件下,最佳温度应控制在_____左右。
②若不使用CO,温度超过775 K,发现NO的分解率降低,其可能的原因为___
③用平衡移动原理解释为什么加入CO后NO转化为N2的转化率增大?______
【答案】 -84.4 B ![]() 0.1 870K (860~880K 范围都可以) NO直接分解成N2的反应是放热反应,升高温度不利于反应进行 加入的CO与NO分解生成的O2反应,使NO分解平衡向生成N2的方向移动,因此NO转化率升高
0.1 870K (860~880K 范围都可以) NO直接分解成N2的反应是放热反应,升高温度不利于反应进行 加入的CO与NO分解生成的O2反应,使NO分解平衡向生成N2的方向移动,因此NO转化率升高
【解析】试题分析:本题考查化学反应中的能量变化和盖斯定律的应用,化学平衡常数表达式的书写和化学平衡的计算,图像分析,外界条件对化学平衡的影响。
(1)应用盖斯定律,反应I+反应II得2NO(g)+CO(g)=CO2(g)+N2O(g)ΔH=(-8kcal/mol)+(-76.4kcal/mol)=-84.4kcal/mol。使用催化剂能降低反应的活化能,使用催化剂时反应I、反应II以及总反应都是放热反应,反应I、反应II以及总反应的反应物的总能量大于相应生成物的总能量,符合题意的为B,答案选B。
(2)①根据化学方程式可写出化学平衡常数表达式K=![]() 。
。
②用三段式, 2NO(g)+2CO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
n(起始)(mol) 0.2 0.2 0 0
n(转化)(mol) a a a/2 a
n(平衡)(mol) 0.2-a 0.2-a a/2 a
达到平衡后气体的压强为开始的0.875倍,0.2-a+0.2-a+a/2+a=0.875![]() (0.2+0.2),解得a=0.1。
(0.2+0.2),解得a=0.1。
(3)①根据图像n(NO)/n(CO)=1条件下,反应温度为870K左右时NO还原为N2的转化率已经很大,继续升高温度NO还原为N2的转化率增大不明显,最佳温度控制在870K左右。
②若不使用CO,则NO直接发生分解反应:2NO(g)![]() N2(g)+O2(g)ΔH
N2(g)+O2(g)ΔH![]() 0,温度超过775K时NO分解率降低的原因可能是:该反应为放热反应,升高温度平衡向逆反应方向移动,不利于NO转化为N2,NO的分解率降低。
0,温度超过775K时NO分解率降低的原因可能是:该反应为放热反应,升高温度平衡向逆反应方向移动,不利于NO转化为N2,NO的分解率降低。
③加入的CO与NO分解生成的O2反应,使NO分解平衡向生成N2的方向移动,NO的转化率升高,所以加入CO后NO转化为N2的转化率增大。


科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
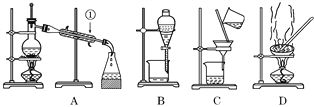
(1)从氯化钾溶液中得到氯化钾固体,选择装置______(填字母,下同);除去自来水中的可溶性物质,选择装置__________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________________________。
(3)装置A中①中水的进出方向是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离于方程式书写正确的是
A. 加热CuSO4溶液:Cu2++2H2O![]() Cu(OH)2↓+2H+
Cu(OH)2↓+2H+
B. 泡沫灭火器工作时的化学反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑
C. 以石墨为电极电解MgCl2溶液:2Cl-+2H2O![]() Cl2+H2↑+OH-
Cl2+H2↑+OH-
D. 向NH4HCO3溶液中加入过量的NaOH(溶液)加热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学键的键能(指将1mol气态分子拆开形成气态原子时,每个化学键断裂所需的最低能量)数据如表所示:
化学键 | C-H | C=C | H-H | C-C |
键能/(KJ/mol) | 413.4 | x | 436.0 | 347.7 |
已知CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH=-123.5kJ/mol,x的值为
CH3CH3(g) ΔH=-123.5kJ/mol,x的值为
A. 136.8 B. 307.5 C. 615.0 D. 177.3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法不正确的是
A. 4.4g 由CO2和N2O 组成的混合气体中含有的原子总数为0.3NA
B. 0.1mol H2和0.1molI2 于密闭容器中充分反应后,其分子总数为0.2NA
C. 1.8g18O2中含有的中子数为NA
D. 5.6g 铁粉在2.24L( 标准状况下)氯气中燃烧,转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
NH2COONH4(s)。该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢铵。
(1)该反应在一定条件下能够自发进行,则反应的ΔH________0。(填大于、小于或等于)
(2)写出生成碳酸氢铵的化学方程式________。
(3)实验步骤如下:

步骤1:按图所示组装仪器,检查装置气密性。
步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品
……
①干燥管中盛放的药品是_________。
②对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点有______,_______。
③以恒压滴液漏斗代替分液漏斗的目的是________________。
④反应后期CO2气流量下降时,可采取的相应措施是______________。
(4)该实验装置中可能存在的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。回答下列问题:
(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以
B.氢硫酸的导电能力低于相同浓度的亚硫酸
C.0.10 mol·L-1的氢硫酸和亚硫酸的pH分别为4.5和2.1
D.氢硫酸的还原性强于亚硫酸
(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。

通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为_______,制得等量H2所需能量较少的是________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
COS(g)+H2O(g)。在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率α1=________%,反应平衡常数K=________。
②在620 K重复实验,平衡后水的物质的量分数为0.03,H2S的转化率α2_______α1,该反应的ΔH________0。(填“>”“<”或“=”)
③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)。
A.H2S B.CO2 C.COS D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过碳酸钠和盐酸反应的化学方程式为:2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中一般都含有Na2CO3,为了测定它的纯度,取一定量的样品和盐酸反应,通过测量产生的氧气的体积,可以计算出过碳酸钠的含量。
(1) 根据下图提供的仪器装置,组装一套测定商品过碳酸钠的实验装置,这些装置的连接顺序是(填接口字母):_______________。
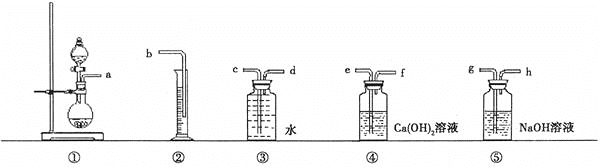
(2) 装置④的作用:______________________。装置⑤的作用为_________________________________。
(3) 如果实验时,称取wg样品和过量盐酸反应后,设收集到氧气的体积(标准状况)为VmL,则此样品的纯度为______________。(列出计算式,不需化简)
(4) 某次实验,称取1.22g样品进行测定,实验室有50mL,100mL,150mL三种规格的量筒,应选用规格为_______的量筒进行实验。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 R、T、Q、W 在元素周期表中的相对位置如图所示,其中 T 所处的周期序数与族序数相等.下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含 T 的盐溶液一定能电离出 T 的阳离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com