
X��Y��Z��ԭ���������ε����Ķ�����Ԫ�أ�3��Ԫ�ص�ԭ�Ӻ��������֮����Ca2���ĺ����������ȣ�X��Z�ֱ�õ�һ�����Ӻ���γ�ϡ������ԭ�ӵ��ȶ����Ӳ�ṹ������˵����ȷ����
A��ԭ�Ӱ뾶��Z��Y��X
B��Z��X�γɻ�����ķе����Z��ͬ��Ԫ����X�γɻ�����ķе�
C��CaY2��ˮ����������ԭ��Ӧʱ��CaY2ֻ��������
D��CaX2��CaY2��CaZ2��3�ֻ������У��������������Ӹ����Ⱦ�Ϊ1�U2
B
��������Ca2+�ĺ��������Ϊ18��X���ڷֱ�õ�һ�����Ӻ���γ�ϡ������ԭ�ӵ��ȶ����Ӳ�ṹ˵��X��Z���γɸ�1�����ӣ���XΪH��ZΪF����X������ΪF��Z������ΪCl���ɴ˿ɽ�һ���Ƴ�YΪO��ԭ�Ӱ뾶��O>F>H��A�����HF���Ӽ�������������е���ͬ����Ԫ���⻯������ߵģ�B����ȷ��CaO2��ˮ������Ӧʱ��O22���绯��������������������ԭ����C�����CaO2�е��������������Ӹ����Ⱦ�Ϊ1:1��D�����
�����㶨λ�����⿼�������Ԫ�ص������ƶϺ�Ԫ�����ڱ�֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014�Ϻ��б�ɽ���߶��꼶��ѧѧ��������⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
���и�����ʽ��д��ȷ����
A. �Ȼ���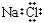 B. ����
B. ����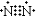 C. �Ȼ���
C. �Ȼ���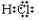 D��������̼
D��������̼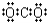
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ�����Ͼ������棩 ���ͣ�ѡ����
��ˮ����һ����������������������Cu2+��Hg2+��Pb2+���ؽ������ӣ��ɼ��������ʹ��������������ʲ�����Ϊ����������
A����ˮ B����������
C����������Һ D��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ�����Ͼ������棩 ���ͣ�ѡ����
����ʵ�������ȷ����
A�����ð�ˮ��ȥ�Թ��ڱ��ϵ�����
B����������ҺӦ�����ڴ����������Լ�ƿ��
C�������Ȼ�����Һ���ɣ����Ƶ���ˮ���Ȼ���
D��п��ϡ���ᷴӦʱ��Ҫ�Ӵ�Ӧ���ʿɵμ���������ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ���㽭�������棩 ���ͣ������
[14��]��֪��I2��2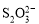

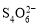 ��2I�D��������ʵ��ܶȻ��������±���
��2I�D��������ʵ��ܶȻ��������±���
���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
��1��ij����CuCl2��Һ�к���������FeCl3��Ϊ�õ�������CuCl2?2H2O���壬���� ����pH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��____________________��
���˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2?2H2O���塣
��2���ڿ�����ֱ�Ӽ���CuCl2?2H2O����ò���������ˮCuCl2��ԭ����_______________�����û�ѧ����ʽ��ʾ������CuCl2?2H2O����õ�������ˮCuCl2�ĺ���������_______��
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2?2H2O�������������������I�D������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
����ѡ��___________���ζ�ָʾ�����ζ��յ��������_________________��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ______________________________��
����������CuCl2?2H2O�������ٷ���Ϊ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ���¿α�����棩 ���ͣ������
��ѡ��2��ѧ�뼼����(15��)
�ɻ�ͭ��(��Ҫ�ɷ���CuFeS2)���ƾ�ͭ�Ĺ�������ʾ��ͼ���£�

��1���ڷ���¯�У���ͭ����ɰ��ʯӢɰ��ϼ��ȵ�1000�����ң���ͭ���������Ӧ
����Cu��Fe�ĵͼ�����Ҳ���Fe������ת��Ϊ�ͼ�������ù�����������
Ҫ��Ӧ�Ļ�ѧ����ʽ�ֱ��� ��
������¯������¯������Ҫ�ɷ��� ��
��2����ͭ��Cu2S��FeS�����ۺ϶��ɣ���Cu��Ϊ20%--50%��ת¯�У�����ͭ��
�ۼ���ʯӢɰ����1200�����Ҵ���������д�������ͭ�е�Cu2S������ΪCu2O������Cu2O��Cu2S��Ӧ�����ɺ�Cu��ԼΪ98.5%�Ĵ�ͭ���ù��̷�����Ӧ�Ļ�ѧ����ʽ�ֱ��� �� ��
��3����ͭ�ĵ�⾫������ͼ��ʾ���ڴ�ͭ�ĵ������У���ͭ��Ӧ��ͼ�е缫_ _����ͼ�е���ĸ�����ڵ缫d�Ϸ����ĵ缫��ӦʽΪ ������ͭ�л�����Au��Ag��Fe�������ڵ����еĴ�����ʽ��λ��Ϊ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ���¿α�����棩 ���ͣ�ѡ����
����ʽΪC5H12O�ҿ�������Ʒ�Ӧ�ų��������л��������У������������칹��
A.5�� B.6�� C.7�� D.8��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ���Ի�ѧ��ɽ���������棩 ���ͣ������
��12�֣���2012?ɽ����[��ѧ�����ʽṹ������]�������ڵ�ء��Ͻ𡢴����ȷ���Ӧ�ù㷺��
��1�����й��ڽ�������������˵����ȷ������ ����
a�����������з������뱥����
b���������ǽ��������������ɵ��Ӽ�������
c��������������Ϊ����ӵ糡�����²������ɵ���
d���������й�������Ϊ�������������ղ��ų��ɼ���
��2��Ni��Ԫ�����ڱ��е�28��Ԫ�أ��ڶ����ڻ�̬ԭ��δ�ɶԵ�������Ni��ͬ�ҵ縺����С��Ԫ������ ����
��3�����˽��������Ni��CO��n������ԭ�Ӽ۵������������ṩ��������֮��Ϊ18����n=�� ��CO��N2�ṹ���ƣ�CO�����ڦҼ���м�����֮��Ϊ�� ����
��4����ȩ��H2C�TO����Ni�������¼���ɵü״���CH3OH�����״�������Cԭ�ӵ��ӻ���ʽΪ�� �����״������ڵ�O��C��H������ ��������ڡ������ڡ���С�ڡ�����ȩ�����ڵ�O��C��H���ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2014�Ĵ�ʡ�˲��д������п��Ը�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
������Ԫ��Q��R��T��W��Ԫ�����ڱ��е�λ�����£�����Tԭ�ӵ�M���������K���2����������������ȷ���� �� ��
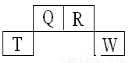
A��H2R2�ķ����мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ�
B��Q��R����������������������������������Ne������ͬ
C��T����������һ�����õİ뵼�����
D��Q���⻯����W���⻯�ﷴӦ�а����������������мȺ������Ӽ����ֺ��й��ۼ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com