



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| ||
| n |
| 33.6 |
| n |
| 33.6 |
| m |
| 11.2 |
| m |
| 11.2 |
| m-n |
| 22.4 |
| m-n |
| 22.4 |
查看答案和解析>>
科目:高中化学 来源:2010年湖北省武汉市武昌区高三五月调研测试理综化学试题 题型:填空题
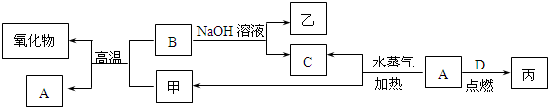
(15分)A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,其中D为黄绿色。甲、乙、丙为常见的化合物。它们之间的转化关系如下图所示:
回答下列问题:
(1)化合物乙的名称__________。
(2)B与甲反应的化学方程式是____________________。
(3)由丙的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是__________;若要提纯该胶体,采用的操作方法叫_____。如果用该胶体做电泳实验,___极附近颜色加深。
(4)将A、B两种金属按一定的质量比组成混合物。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,混合物中B的物质的量为_____mol(用含字母的代数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积的标准状况下为mL,该反应中转移电子的物质的量为_____mol,原混合物中A的质量为__________g(用含字母的代数式表示)。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌后,过滤,沉淀经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中B的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省怀化市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
已知A、B、C、D、E、F六种短周期元素中,A、B、C、D是组成蛋白质的基本元素;A与B的原子序数之和等于C原子核内的质子数;A与E、D与F分别位于同一主族,且F原子核内的质子数是D原子核外电子数的2倍。据此,请回答:
(1)F在周期表中的位置是____________________________。
(2)由A、C、D、F按8:2:4:1原子个数比组成的化合物甲中含有的化学键类型为____________;甲溶液中各离子浓度由大到小的顺序为________________(用离子浓度符号表示)。
(3)化合物乙由A、C组成且相对分子质量为32;化合物丙由A、D组成且分子内电子总数与乙分子内电子总数相等;乙与丙的反应可用于火箭发射(反应产物不污染大气),则该反应的化学方程式为_________________________________________。
(4)由A、D、E、F组成的化合物丁能与硫酸反应并放出刺激性气味的气体,则丁的化学式为________;实验测得丁溶液显弱酸性,由此你能得出的结论是___________________。
(5)由B、A按1:4原子个数比组成的化合物戊与D的常见气态单质及NaOH溶液构成原电池 (如图),试分析:
(如图),试分析:

①闭合K,写出左池X电极的反应式__________________________________;
②闭合K,当X电极消耗1.6g化合物戊时(假设过程中无任何损失),则右池两极共放出气体在标准状况下的体积为_________升。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,其中D为黄绿色。甲、乙、丙为常见的化合物。它们之间的转化关系如下图所示:

回答下列问题:
(1)化合物乙的名称__________。
(2)B与甲反应的化学方程式是____________________。
(3)由丙的饱和溶液可以制得胶体,胶体中粒子直径的大小范围是__________;若要提纯该胶体,采用的操作方法叫_____。如果用该胶体做电泳实验,___极附近颜色加深。
(4)将A、B两种金属按一定的质量比组成混合物。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为nL,混合物中B的物质的量为_____mol(用含字母的代数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积的标准状况下为mL,该反应中转移电子的物质的量为_____mol,原混合物中A的质量为__________g(用含字母的代数式表示)。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌后,过滤,沉淀经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中B的质量分数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D是四种常见的单质,A、B为金属,C、D常温下是气体,且D为黄绿色气体。甲、乙、丙为常见的化合物,甲是黑色且具有磁性的物质。它们之间的转化关系如下图所示:

请回答下列问题:
(1)B与甲反应的化学方程式是 。
(2)常温下,将A或B的单质放入浓硫酸或浓硝酸中,是否溶解? (填“是”或“否”)。
(3)将丙溶于水配成溶液,检验丙中阳离子的方法是
。
(4)写出A与水蒸气反应生成C和甲的化学方程式 。
(5)将A、B两种金属按一定的质量比组成混合物。
①取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,B与NaOH溶液反应的离子方程式是 ,混合物中B的物质的量为 mol(用含字母的分数式表示)。
②另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为m L,该反应中转移电子的物质的量为 mol,混合物中A的质量为 g(用含字母的分数式表示)。
③向②所得的溶液中加入过量的氢氧化钠溶液,充分搅拌,将产生的沉淀过滤出来,经洗涤、干燥、灼烧后得到一种固体,经称量发现该固体的质量和原混合物的质量恰好相等,则原混合物中铝的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com