
【题目】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
(1)X与Y所形成化合物晶体的晶胞如图所示.在1个晶胞中,X离子的数目为 .
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 .
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 .
(4)Y与Z可形成YZ42﹣ , YZ42﹣的空间构型为(用文字描述);写出一种与YZ42﹣互为等电子体的分子的化学式: . 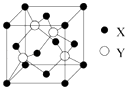
【答案】
(1)4
(2)sp3杂化
(3)水分子与乙醇分子之间形成氢键
(4)正四面体;CCl4或SiCl4
【解析】解:元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.(1)在一个晶胞中,X离子的数目8× ![]() +6×
+6× ![]() =4,所以答案是:4;(2)H2S分子中S原子杂化轨道数目为2+
=4,所以答案是:4;(2)H2S分子中S原子杂化轨道数目为2+ ![]() =4,S原子采取sp3杂化,所以答案是:sp3杂化;(3)水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,所以答案是:水分子与乙醇分子之间形成氢键;(4)SO42﹣中S原子孤电子对数为
=4,S原子采取sp3杂化,所以答案是:sp3杂化;(3)水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,所以答案是:水分子与乙醇分子之间形成氢键;(4)SO42﹣中S原子孤电子对数为 ![]() =0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42﹣互为等电子体的分子的化学式:CCl4或SiCl4 , 所以答案是:正四面体;CCl4或SiCl4 .
=0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42﹣互为等电子体的分子的化学式:CCl4或SiCl4 , 所以答案是:正四面体;CCl4或SiCl4 .


科目:高中化学 来源: 题型:
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( ) 
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2+2H++2e一═HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关卤族元素的说法中,正确的是 ( )
A. 原子半径:F>C1>Br>IB. 最外层电子数:F>C1>Br>I
C. 熔、沸点:F2>Cl2>Br2>I2D. 热稳定性:HF>HCl>HBr>HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(多选)向含b mol Na2CO3的溶液中缓慢滴加含a mol HCl溶液,并不断振荡,下列说法不正确的是( )
A.当 ![]() >2时,发生的离子反应为:CO32﹣+H+═HCO3﹣ , HCO3﹣+H+═CO2↑+H2O
>2时,发生的离子反应为:CO32﹣+H+═HCO3﹣ , HCO3﹣+H+═CO2↑+H2O
B.当0< ![]() <1时,发生的离子反应为:CO32﹣+H+═HCO3﹣
<1时,发生的离子反应为:CO32﹣+H+═HCO3﹣
C.当2a=3b时,发生的离子反应为:2CO32﹣+3H+═HCO3﹣+CO2↑+H2O
D.当1< ![]() <2时,溶液中n(HCO3﹣)为(2a﹣b)mol
<2时,溶液中n(HCO3﹣)为(2a﹣b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取1mol H2S完全燃烧生成液态水和气态二氧化硫,放出热量为Q1;不完全燃烧生成气态水和硫,放出热量为Q2;不完全燃烧生成液态水和硫,放出热量为Q3 , 则下列关系正确的是( )
A.Q3>Q2>Q1
B.Q1>Q2>Q3
C.Q1>Q3>Q2
D.Q2>Q1>Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃的分子式为C10H14 , 不能使溴水褪色,但可使酸性高锰酸钾溶液褪色,分子结构中只含有一个侧链烃基,则此侧链烃基的结构共有( )
A.2种
B.3种
C.4种
D.5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种优质燃料,
(1)已知一定条件下88gCO2和足量氢气完全反应三可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量.请回答: ①该反应的热化学方程式: .
②若生成3mol甲醇放出的热量为 .
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图. 
请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)= .
②下列措施中能使CO2反应速率增大的是 .
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.升高温度
③能够说明该反应已达到平衡的是 .
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH.
E.有2个C=O键断裂的同时,有3个H﹣H键断裂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为;
(2)目前工业上有一种方法是用CO2来生产燃料甲醇:CO2(g)+3H2(g)═CH3OH(g)+H2O(g);如图1表示该反应过程中能量的变化.该反应是△H0(填“>”或“<”); 
(3)比较下面各组热化学方程式,前一反应放出热量Q 较多的是
A.2H2(g)+O2(g)=2H2O(g)△H1 2H2(g)+O2(g)=2H2O(l)△H2
B.S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2
C.C(s)+ ![]() O2(g)=CO(g)△H1 C(s)+O2(g)=CO2(g)△H2
O2(g)=CO(g)△H1 C(s)+O2(g)=CO2(g)△H2
(4)101kPa条件下,14gN2和3gH2反应生成NH3的能量变化如图2所示: 已知:①b=1173;②25℃,101 kPa下N2(g)+3H2(g)2NH3(g)△H=﹣92 kJ/mol则a= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com