
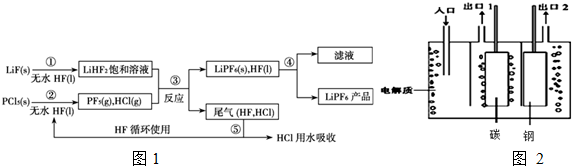
分析 (1)①玻璃的主要成分中含有二氧化硅,能和HF发生反应;HF属于弱酸,必须用弱碱性溶液来除去;
②根据元素组成可知,两种酸分别是H3PO4和HF;
③分离液体和不溶于液体固体采用过滤分离,HF分子间含有氢键,沸点大于HCl,可采用冷凝法分离;
(2)①阴极的电极反应式为2HF2-+2e-═H+4F-,阳极发生氧化反应,F-失去电子生成F2,整个过程生成H2、F2、KF;
②钢电解应为阴极,碳为阳极,阳极生成气体为氟气;
(3)根据沉淀溶解平衡移动分析.
解答 解:(1)①玻璃的主要成分中含有二氧化硅,能和HF发生反应,化学方程式为SiO2+4HF═SiF4↑+2H2O;HF属于弱酸,必须用弱碱性溶液来除去(比如2%的NaHCO3溶液);
故答案为:SiO2+4HF═SiF4↑+2H2O;NaHCO3;
②根据题目中的信息“PF5极易水解,其产物为两种酸”,则根据元素组成可知,两种酸分别是H3PO4和HF,所以反应的方程式为PF5+4H2O═H3PO4+5HF,
故答案为:PF5+4H2O═H3PO4+5HF;
③第④步分离的是固体(LiPF4(s))和液体(HF(l)),所以采用过滤的方法;分离尾气中HF、HCl,可以利用二者沸点的差异(HF分子之间存在氢键)进行分离,所以采用冷凝法,
故答案为:过滤;冷凝;
(2)①阴极的电极反应式为2HF2-+2e-═H+4F-,阳极发生氧化反应,F-失去电子生成F2,整个过程生成H2、F2、KF,电解总反应式为 2KHF2$\frac{\underline{\;电解\;}}{\;}$H2↑+F2↑+2KF,故答案为:2KHF2$\frac{\underline{\;电解\;}}{\;}$H2↑+F2↑+2KF;
②钢电解应为阴极,碳为阳极,阳极生成气体为氟气,故出口1处的物质为F2,
故答案为:F2;
(3)牙齿表面有一层釉质,其组成为羟基磷灰石Ca5(PO4)3OH(Ksp=6.8×10-21),羟基磷灰石在水中存在平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq),因为酸使上述平衡向右移动而被腐蚀,当加入氟化物时发生反应生成溶解度更小的氟磷灰石:5Ca2+(aq)+3PO43-(aq)+F- (aq)=Ca5(PO4)3F(s),实现了羟基磷灰石转化为更耐腐蚀的氟磷灰石,因次使用氟化物能防止蛀牙;
故答案为:牙齿表面的羟基磷灰石在水中存在平衡:Ca5(PO4)3OH(s)?5Ca2+(aq)+3PO43-(aq)+OH-(aq),因为酸使上述平衡向右移动而被腐蚀;当加入氟化物时发生反应生成溶解度更小的氟磷灰石:5Ca2+(aq)+3PO43-(aq)+F- (aq)=Ca5(PO4)3F(s),实现了羟基磷灰石转化为更耐腐蚀的氟磷灰石,因次使用氟化物能防止蛀牙.
点评 本题为无机化学流程题,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,涉及流程分析、分离提纯、方程式书写、沉淀的转化等知识,注意题干所给信息的使用,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力.


科目:高中化学 来源: 题型:选择题
| 事实 | 推测 | |
| A | Mg与水反应缓慢,Ca与水反应较快 | Be与水反应会更快 |
| B | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
| C | SiH4,PH3在空气中能自燃 | H2S在空气中也能自燃 |
| D | 标况下HCl,HBr均为气体 | HF也为气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

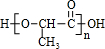 .
.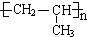 ,该反应类型是加聚反应.
,该反应类型是加聚反应.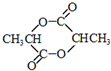 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可做食物调味剂,也可做食品防腐剂 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,都利用了强氧化性 | |
| C. | 海水淡化的方法主要有蒸馏法、离子交换法等 | |
| D. | 通常所说的三大合成材料是指塑料、合成橡胶和合成纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
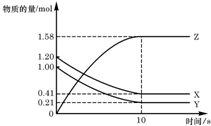 一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在 2L 的密闭容器中,X、Y、Z 三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到 10s,用 Z 表示的反应速率为 0.158mol/(L•s) | |
| B. | 反应开始到 10s,X 的物质的量浓度减少了 0.79mol/L | |
| C. | 反应开始到 10s,Y 的转化率为 79.0% | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
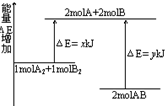
| A. | 该反应是吸热反应 | |
| B. | 断裂1molA-A键和1molB-B键共可放出xKJ能量 | |
| C. | 断裂1molA-B键需要吸收yKJ能量 | |
| D. | 1molA2和1molB2完全反应生产2molAB,放出(y-x)KJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
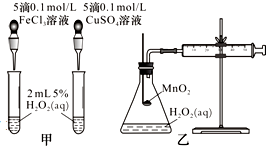 影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究.| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com