
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 原子的最外层电子数是次外层电子数的3倍. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和. |
| E | 生产和生活中用量最大的金属. |
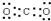 ,故答案为:分子;
,故答案为:分子;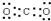 ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.
X、Y、Z为三种短周期元素,原子序数之和为32,X和Y为相邻周期的元素,Y和Z为同周期的元素.Y的质子数比X多5个,X的最外层电子数为Y最外层电子数的2倍,X的最外层电子数和Z的最外层电子数之和为7;W+中所有电子正好充满K、L、M三个电子层.查看答案和解析>>
科目:高中化学 来源: 题型:
 我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.
我国濒临海域的省份,能够充分利用海水制得多种化工产品.如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中固体B是生活中的一种必需品,E是一种化肥,N是一种常见的金属单质.查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | AlF3 | AlCl3 | AlBr3 |
| 沸点/℃ | 1260 | 181(升华) | 263 |
| A、NaCl和CCl4 |
| B、Na2O和SiO2 |
| C、金刚石和金属铝 |
| D、碘和干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所得氯气的相对分子质量约为71 |
| B、KCl中只含35Cl |
| C、所得的KCl中既含35Cl又含37Cl |
| D、被氧化和被还原的氯原子数之比为5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰融化时,分子中H-O键发生断裂 |
| B、随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高 |
| C、由于H-O键比H-S键牢固,所以水的熔沸点比H2S高 |
| D、在由分子所构成的物质中,分子间作用力越大,该物质越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用量筒量取硝酸的体积时,俯视读数偏低 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、蛋白质溶液具有丁达尔效应,说明该蛋白质分子直径约1 nm~100 nm |
| D、向淀粉溶液中加入稀硫酸,加热几分钟,冷却后再加入新制Cu(OH)2浊液加热,可以检验水解产物葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com