
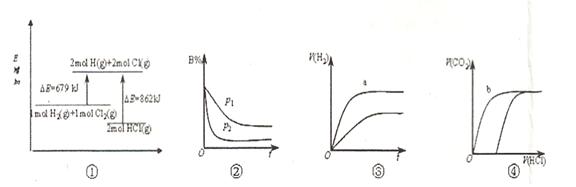
| A.①表示化学反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的反应热△H=183kJ/mol |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积百分含量)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl和CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示CH3COOH溶液 |
| D.④表示10mL 0.1mol/L Na2CO3和NaHCO3两种溶液中,分别滴加0.lmol/LHCl,产生CO2的体积随盐酸体积的变化,则b表示Na2CO3溶液 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H="-92" kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)| A.升高温度 | B.使用催化剂 |
| C.及时移出氨 | D.循环利用和不断补充氮气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
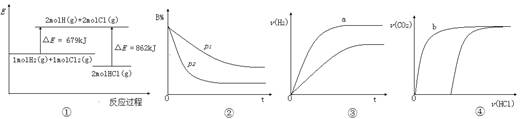
| A.①表示反应H2(g)+Cl2(g)=2HCl(g)的能量变化,则该反应的△H="183" kJ·mol-1 |
B.②表示其它条件不变时,反应4A(g)+3B(g) 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 2C(g)+6D在不同压强下B%(B的体积分数)随时间的变化,则D一定是气体 |
| C.③表示体积和pH均相同的HCl、CH3COOH两种溶液中,分别加入足量的锌,产生H2的体积随时间的变化,则a表示的是HCl溶液 |
| D.④表示10 mL 0.1 mol·L-1 Na2CO3和NaHCO3两种溶液中,分别滴加0.l mol/L HCl溶液时,CO2的体积随盐酸体积的变化,则b表示的是NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验①中,反应生成的Mn2+可能是该反应的催化剂 |
| B.实验②中,该反应是太阳能转变为光能 |
| C.实验③中,有气泡产生的棒是铁棒 |
| D.实验④中,加入的水是反应的催化剂,且该反应能自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 的原料。已知:
的原料。已知: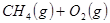
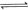



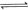
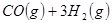


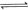


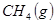 与
与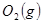 反应生成
反应生成 的热化学方程式为 。
的热化学方程式为 。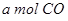 与
与 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: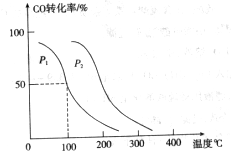

 (填“<”、“>”或“=”)
(填“<”、“>”或“=”) 、
、 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含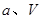 的代数式表示)。
的代数式表示)。 电极通入的
电极通入的 为 ,电极反应式是 。
为 ,电极反应式是 。
 溶液,当得到
溶液,当得到 铜时,参加反应的气体
铜时,参加反应的气体 的体积应为
的体积应为  (标准状况)。
(标准状况)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O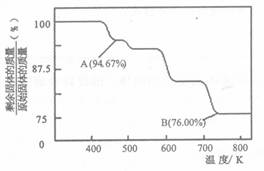
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com