
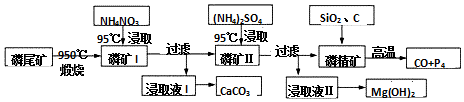

分析 磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4,可生成P4,以此解答该题;
(1)在950℃下煅烧磷尾矿,根据产物判断Ca5(PO4)3F是否分解;
(2)NH4NO3因水解其溶液显酸性,CaSO4是微溶于水的盐;
(3)磷精矿与SiO2、C发生反应时发生的反应为4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4,可结合化合价的变化判断被还原的物质;
(4)石墨Ⅰ电极上CO发生氧化反应,可知石墨Ⅰ电极为负极,结合电解质是熔融的Na2O,可写出此反应的电极反应式,原电池工作时阳离子向正极移动;
(5)①常温下关于1L 0.1mol•L-1 HCOONa溶液,有水的电离平衡、和HCOO-的水解平衡,存在水的离子积常数是定徝、电荷守恒、物料守恒,且0.1mol•L-1 HCOONa溶液显碱性,据此判断各选项;
②向1L 0.1mol•L-1 HCOONa溶液中加水稀释,促进HCOO-的水解,由此判断c(HCOOH)•c(OH-)的数值变化.
解答 解:磷尾矿[主要含Ca5(PO4)3F和CaCO3•MgCO3]在950℃下煅烧,其中碳酸钙和碳酸镁分解,生成气体的成分为二氧化碳(CO2),磷矿Ⅰ的主要成分为Ca5(PO4)3F、CaO、MgO,NH4NO3溶液中铵离子水解呈酸性,可溶解CaO,得到的浸取液Ⅰ含有Ca2+,可生成CaCO3,磷矿Ⅱ含有Ca5(PO4)3F、MgO,加入硫酸铵浸取,浸取液Ⅱ含有镁离子,可生成氢氧化镁,磷精矿加入二氧化硅、C等,在高温下发生4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4;
(1)在950℃下煅烧磷尾矿,Ca5(PO4)3F没有分解,可知磷精矿[Ca5(PO4)3F]分解温度高于950℃,故答案为:高于;
(2)NH4NO3溶液中铵离子水解呈酸性,H+能从磷矿I中浸取出Ca2+,CaSO4是微溶于水的盐,则不选用(NH4)2SO4,故答案为:NH4+水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+; CaSO4微溶于水,第一次若使用硫酸,不能完全浸取Ca2+;
(3)磷精矿与SiO2、C发生反应时发生的反应为4Ca5(PO4)3F+18SiO2+30C$\frac{\underline{\;高温\;}}{\;}$2CaF2+30CO+18CaSiO3+3P4,反应中P元素的化合价从+5价降为0价,发生还反应,可知被还原的物质是Ca5(PO4)3F,故答案为:Ca5(PO4)3F;
(4)石墨Ⅰ电极是负极,CO发生氧化反应,此反应的电极反应式为CO+O2--2e-=CO2,石墨Ⅱ电极是正极,而原电池工作时Na+向正极移动,故答案为:CO+O2--2e-=CO2;石墨Ⅱ;
(5)①常温下关于1L 0.1mol•L-1 HCOONa溶液中;
a.常温下水的离子积c(H+)•c(OH-)=1×10-14,故a正确;
b. 溶液中存在的电荷守恒式为c(Na+)+c(H+)=c(OH-)+c(HCOO-),物料守恒式为c(Na+)=c(HCOOH)+c(HCOO-),则c(H+)+c(HCOOH)=c(OH-),故b正确;
c.溶液中存在的物料守恒式为c(Na+)=c(HCOOH)+c(HCOO-),故c正确;
d.HCOONa是强碱弱酸盐,其溶液显碱性,c(OH-)>c(H+),故d错误;答案为d;
②向1L 0.1mol•L-1 HCOONa溶液中加水稀释,促进HCOO-的水解,c(HCOO-)减小,c(HCOOH)•c(OH-)=$\frac{c(HCOOH)•c(O{H}^{-})•c({H}^{+})}{c({H}^{+})}$=${K}_{w}×\frac{c(HCO{O}^{-})}{c({H}^{+})}$=${K}_{w}×\frac{c(HCO{O}^{-})}{{K}_{a}(HCOOH)}$,则其减小,故答案为:减小.
点评 本题考查物质的制备,涉及化学反应原理,涉及盐类的水解、弱电解质的电离、离子浓度的大小比较等知识,题目难度较大,注意掌握实验的原理和流程,把握电离平衡常数和水的离子积常数的意义,充分培养了学生的分析、理解能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
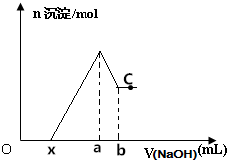 将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )
将某镁铝合金投入一定体积的稀盐酸中,待合金完全溶解后往溶液里滴入1mol/L的NaOH溶液,生成沉淀物质的量与加入NaOH溶液体积的关系如图所示,下列说法中错误的是( )| A. | C点对应的沉淀为Mg(OH)2 | |
| B. | Al的质量为27(b-a)×10-3 | |
| C. | 该合金与盐酸反应产生的H2为(a-x)×10-3mol | |
| D. | 由图可以确定x的取值范围为:0≤x<(4a-3b) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的数量 | |
| B. | Mg2+的摩尔质量为24g/mol | |
| C. | 标准状况下,22.4L水的物质的量为1mol | |
| D. | 80g NaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①或② | B. | ①或④ | C. | ②或③ | D. | ②或④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜与硝酸反应 | B. | 明矾溶液与烧碱溶液反应 | ||
| C. | 碳酸钠溶液和盐酸反应 | D. | 硫在氧气中燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com