
| A. | 向AgCl悬浊液中加入KBr溶液:Ag++Br-=AgBr | |
| B. | 用铁棒作阴极、碳棒作阳极电解饱和氯化镁溶液:2C1-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- | |
| C. | 向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸:2OH-+CO32-+4H+═CO2↑+3H2O | |
| D. | 在强碱性溶液中NaClO与Fe(OH)3生成Na2FeO4:4OH-+3ClO-+2Fe(OH)3═2FeO43-+3C1-+5H2O |
分析 A.氯化银为沉淀应保留化学式;
B.氢氧化镁为沉淀应保留化学式;
C.盐酸先与氢氧化钠反应,再与碳酸钠反应,盐酸量少生成碳酸氢钠;
D.在强碱性溶液中NaClO与Fe(OH)3发生氧化还原反应生成高铁酸钠和水、氯化钠.
解答 解:A.向AgCl悬浊液中加入KBr溶液,离子方程式:AgCl+Br-=AgBr+Cl-,故A错误;
B.用铁棒作阴极、碳棒作阳极电解饱和氯化镁溶液,离子方程式:2C1-+Mg2++2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2Mg(OH)2↓,故B错误;
C.向等物质的量浓度的NaOH和Na2CO3的混合溶液中加入稀盐酸,离子方程式:OH-+CO32-+3H+═CO2↑+2H2O,故C错误;
D.在强碱性溶液中NaClO与Fe(OH)3生成Na2FeO4,离子方程式:4OH-+3ClO-+2Fe(OH)3═2FeO43-+3C1-+5H2O,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意反应物用量对反应的影响,选项CD为易错选项.


科目:高中化学 来源: 题型:选择题
| A. | 某温度下,任何电解质的稀溶液中,pC(H+)+pC(OH-)=14 | |
| B. | 0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大 | |
| C. | 0.01mol/L的BaCl2 溶液中,pC(Cl-)=2pC(Ba2+) | |
| D. | 用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该转化过程是物理变化 | |
| B. | 1molCO2原子晶体中含2molC-O键 | |
| C. | CO2原子晶体的熔点高于SiO2 | |
| D. | CO2的原子晶体和分子晶体互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
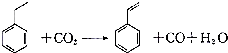
| A. | 分子中含有5个碳碳双键 | B. | 属于不含极性键的共价化合物 | ||
| C. | 分子式为C8H10 | D. | 通过加聚反应生成聚苯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )
向Ba(OH)2和NaOH混合溶液中缓缓通入CO2气体至过量,生成沉淀物质的量与通入CO2气体的体积V(标准状况)的关系如图所示,下列结论不正确的是( )| A. | 原混合物中n[Ba(OH)2]:n[NaOH]=1:2 | |
| B. | 横坐标轴上p点的值为90 | |
| C. | b点时溶质为NaHCO3 | |
| D. | ab段发生反应的离子方程式依次为:CO2+2OH-→H2O+CO32-,CO2+H2O+CO32-→2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | KOH | C. | Al2O3 | D. | MgSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| Cl-O键键长(pm) | Cl-O键能(KJ/mol) | |
| HClO | 170 | 209 |
| HClO3 | 157 | 244 |
| A. | 更高的沸点 | B. | 更强的酸性 | ||
| C. | Cl-O断裂放出的能量更少 | D. | 更易放出原子氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
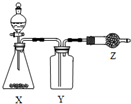 如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )
如图是用于制取、收集并吸收多余气体的装置,如表方案正确的是( )| 选项 | X | Y | Z |
| A | 食盐、浓硫酸 | HCl | 碱石灰 |
| B | CaO、浓氨水 | NH3 | 无水CaCl2 |
| C | Cu、浓硝酸 | NO2 | 碱石灰 |
| D | 电石、食盐水 | C2H2 | 含溴水的棉花 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.
某温度,将2molCO与5molH2的混合气体充入容积为2L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g)?CH3OH(g).经过5min后,反应达到平衡,此时转移电子6mol.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com