
【题目】如图表示可逆反应mA(g)十nB(g)![]() C(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C 的化学计量数的判断中,正确的是( )
C(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C 的化学计量数的判断中,正确的是( )

A.吸热反应,m+n<p B.吸热反应.m+n>p
C.放热反应,m+n<p D.放热反应,m+n>p
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z为不同短周期非金属元素的气态单质。在一定条件下能发生反应:Y+X![]() 甲(g) , Y+Z
甲(g) , Y+Z![]() 乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
乙(g)。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
(1)X的结构式是___________。
(2)磷在Z气体中燃烧可生成液态丙(PZ3)分子,也可生成固态丁(PZ5)分子。磷单质和Z单质反应生成lmol丙时,反应过程与能量变化如图I所示,该反应的热化学方程式是____________。已知1mol白磷固体和Z气体反应,生成固态丁时,放热399kJ,则1mol固态丁转化为丙时的反应热△H=_________
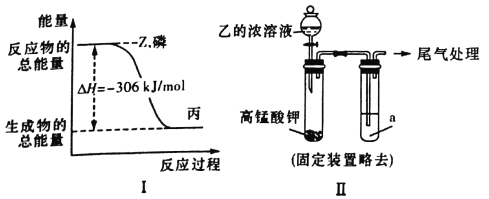
(3)某同学拟用图II所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是_______的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是____。
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由X、Y、Z中的一种或几种元素组成的某纯净物,即可生成白色沉淀,该纯净物可能是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等.实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如图:

(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: .
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是 (部分阳离子以氢氧化物形式沉淀时溶液的pH见表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 .
(4)如何证明洗涤环节充分洗净 .
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 .(用题中所给数据计算并用最简整数比表示结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有下列物质①Cu ②液氨 ③CH3COOH ④NaHCO3 ⑤H2O ⑥熔融NaCl ⑦NH3·H2O ⑧NH4Cl 属于弱电解质的是 (填序号)。
化学式 | NH3·H2O | HCN | CH3COOH | H2CO3 |
电离平衡常数(25℃) | Kb=1.77×10-5 | Ka=4.93×10-10 | Ka=1.76×10-9 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
(2)电离平衡常数是衡量弱电解质电离程度强弱的量。上表中给出几种弱电解质的电离平衡常数,从中可以判断:在相同温度下,同浓度的三种酸溶液的导电能力由大到小的顺序为 。
(3)盐类水解程度的强弱同样与弱电解质的电离程度有一定联系,结合表中数据回答下列问题:
①25℃时,有等浓度的a.NaCN溶液 b.Na2CO3溶液 c.CH3COONa溶液,三种溶液的pH由大到小的顺序为 。(填溶液前序号)
②浓度相同的NaCN溶液与CH3COOK溶液相比,c(Na+)—c(CN-) c(K+)-c(CH3COO-)。(填“>”“<”或“=”)
③将等体积等物质的量浓度的盐酸和氨水混合后,溶液呈 性(填“酸”、“碱”或“中”),用离子方程式表示原因 。
④室温下,若将0.1mol·L-1盐酸滴入20ml0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。b点所示溶液中的溶质是 。

⑤NH4HCO3溶液呈 性(填“酸”、“碱”或“中”)。
(4)结合表中数据,向NaCN溶液中通入少量CO2,所发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷分子结构的说法中,错误的是 ( )
A.甲烷分子中含有4个C—H共价健
B.甲烷分子中C—H共价键的夹角为109°28'
C.甲烷是正四面体结构
D.甲烷是一种直线型分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3molL﹣1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A.开始加入合金的质量可能为3.6g
B.参加反应的硝酸的物质的量为0.1mol
C.沉淀完全时消耗NaOH溶液的体积为100mL
D.溶解合金时产生NO的体积为2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com