
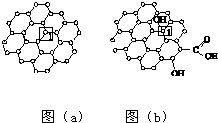
 石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].
石墨烯[如图(a)所示]是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯[如图(b)所示].分析 (1)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键;
(2)图(b)中,1号碳原子形成4个共价单键,所以其价层电子对个数是4,根据价层电子对互斥理论判断C原子杂化方式;图a中1号C原子形成平面结构,图b中1号碳原子形成正四面体结构;
(3)电负性强的O原子与水中的O-H易形成氢键;水中的O原子易与氧化石墨烯中的O-H易形成氢键.
解答 解:(1)每个C原子要形成4个共价键,根据图知,每个C原子形成2个共价单键、1个共价双键,共价单键为σ键、共价双键中1个是σ键、1个是π键,所以该碳原子形成3个σ键,故答案为:3;
(2)图(b)中,1号碳原子形成4个共价单键,所以其价层电子对个数是4,根据价层电子对互斥理论判断C原子杂化方式为;图a中1号C原子形成平面结构,图b中1号碳原子形成正四面体结构,所以该C与相邻C形成的键角<图(a)中1号C与相邻C形成的键角,
故答案为:sp3;<;
(3)水中的O电负性较强,吸引电子能力的强,易与氧化石墨烯中的O-H上的H形成氢键,氧化石墨烯中O与水中的H形成氢键,故答案为:O、H.
点评 本题考查物质结构合性质,为高频考点,涉及氢键、原子杂化方式判断、化学键等知识点,明确原子结构、物质结构和化学键是解本题关键,注意价层电子对互斥理论的灵活运用,注意:氢键不属于化学键,属于分子间作用力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯(SO2、H2O):碱石灰,洗气 | B. | 乙烷(乙烯):酸性 KMnO4,洗气 | ||
| C. | 炭粉(MnO2):热的浓盐酸,过滤 | D. | Cl2(HCl):饱和食盐水,洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
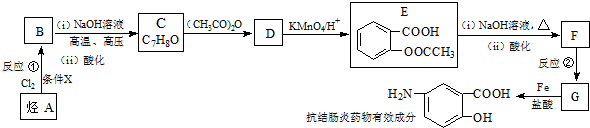
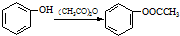
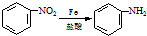
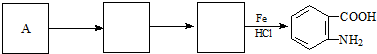
 ;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应;
;反应①的反应条件是FeCl3作催化剂;反应②的反应类型是取代反应; ;
;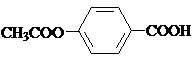 ,
, ;
;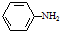 )易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此按先后顺序写出以A为原料合成邻氨基苯甲酸(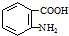 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)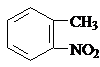 ,
,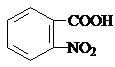 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
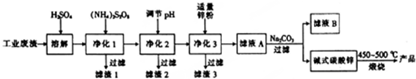
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Al(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.7 | 7.5 | 5.4 | 4.0 | 6.4 |
| 完全沉淀时的pH | 3.7 | 9.5 | 6.6 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
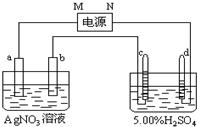
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn、Fe | B. | Fe、Mg | C. | Al、Mg | D. | Zn、Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验 | 解释或结论 |
| A | 向包有Na2O2的脱脂棉滴少量水,脱脂棉燃烧 | Na2O2与H2O反应放热并有O2生成 |
| B | 向NaI溶液滴加FeCl3溶液,再加入CCl4,振荡,静置,下层呈紫红色 | 氧化性:I2>Fe3+ |
| C | 取酸雨试样,滴加H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| D | 用激光笔照射水玻璃(Na2SiO3的溶液),有丁达尔现象 | SiO32-水解生成了硅酸胶体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com