
【题目】某元素X所形成的分子X2共有3种,其相对分子质量依次为158、160、162,其三种分子的物质的量之比是7:10:7则下列结论正确的是( )
A. X有三种同位素
B. 其中一种同位素的原子质量数为81
C. 质量数为79的同位素,其原子质量分数为50%
D. X2的平均相对分子质量为159
【答案】B
【解析】试题分析:A.根据双原子单质分子有三种,确定该元素存在两种同位素;
B.依据两种同位素形成的三种单质的式量分析两种同位素的质量数为79、81;
C.根据三种单质的相对分子质量和物质的量之比进行计算;
D.根据三种单质的相对分子质量和物质的量之比进行计算.
解:A.分子X2共有3种,其相对分子质量依次为158、160、162,推断该元素存在两种同位素才符合,故A错误;
B.根据分子X2共有3种,其式量分别为158、160、162可知,最大的式量为81X2,最小式量为79X2,故B正确;
C.该元素元素的两种同位素的原子设为M、N,构成的双原子单质分子有三种,其式量分别为158、160、162,则原子的同位素只有79、81,形成的单质为79M2、79M81N、81N2三种单质的物质的量之比为7:10:7,计算质量数为79的同位素原子与质量数为81的同位素原子比为:(7×2+10):(10+7×2)=1:1,故质量数为79的同位素,占原子总数的X2的平均相对分子质量百分含量为:50%,则其原子质量分数小于50%,故C错误;
D.X2的平均相对分子质量=![]() =160,故D错误;
=160,故D错误;
故选B.


科目:高中化学 来源: 题型:
【题目】已知:![]() 。若要合成
。若要合成![]() ,则所用的反应物可以是
,则所用的反应物可以是
① 2-甲基-1,3-丁二烯和2-丁炔
② 1,3-戊二烯和2-丁炔
③ 2,3-二甲基-1,3-丁二烯和丙炔
④ 2,3-二甲基-1,3-戊二烯和乙炔
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为中符合安全要求的是( )
A.装运乙醇的包装箱上应贴上易燃液体的危险品标志图标
B.用点燃的火柴在液化气钢瓶口检验是否漏气
C.实验时,将水倒入浓硫酸中配制稀硫酸
D.进入煤矿井时,用火把照明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是____(填元素符号),其中C原子的核外电子排布式为______________;
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是_________________;A和B的氢化物所属的晶体类型分为______________和______________;
(3)C和D反应可生成组成比1:3的化合物E,E的立体构型为________________,中心原子的杂化轨道类型___________________;
(4)化合物D2A的立体构型为______________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_____________________;
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566nm,F的化学式为_________,晶胞中A原子的配位数为__________,列式计算晶体F的密度_____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 硫粉在过量的纯氧中燃烧可以生成大量的SO2
B. 可以用品红溶液鉴别SO2和CO2
C. SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同
D. 少量SO2通过CaCl2的溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100mL 0.3molL﹣1和300mL 0.25molL﹣1的硫酸注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
A.0.21 molL﹣1
B.0.56 molL﹣1
C.0.42 molL﹣1
D.0.26 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究物质的性质具有重要意义。请回答下列问题:
(1)用CO可以合成甲醇。已知:
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(l) ΔH1kJ·mol-1
CO(g)+1/2O2(g)=CO2(g) ΔH2kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) ΔH3kJ·mol-1
则CO(g)+2H2(g)![]() CH3OH(g) ΔH =_______kJ·mol-1。
CH3OH(g) ΔH =_______kJ·mol-1。
(2)一定压强下,在容积为2 L的密闭容器中充入1mol CO与2 mol H2,在催化剂作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。
CH3OH(g) ΔH ,平衡转化率与温度、压强的关系如图所示。

p2 p1 (填“大于”、“小于”或“等于”);
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式_______________。
(4)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=_________。
②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为_________。
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )
A.CO2+H2O=H2CO3 B.2F2+2H2O=4HF+O2
C.Cl2+H2O=HCl+HClO D.2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可以加快氢气的生成速率。请回答下列问题:
(1) 上述实验中发生反应的化学方程式有:
__________________、_____________________;
(2) 硫酸铜溶液可以加快氢气生成速率的原因:__________________;
(3) 实验中现有Na2SO4、MgSO4、 Ag2SO4、 K2SO4四种溶液,可与上述实验中CuSO4溶液起相似作用的是:________;
(4) 要加快上述实验中气体产生的速率,还可以采取的措施有:
_____________________、___________________________(举两种)。
(5) 为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下的一系列的实验。将表中所给的混合溶液分别加到6个盛有过量锌粒的反应瓶中,收集产生的气体,记录获得相同体积气体所需要的时间。
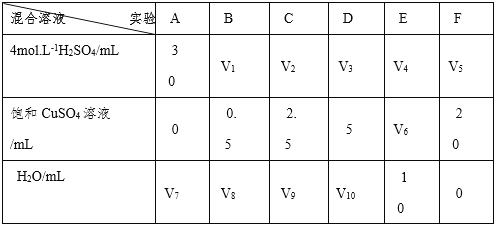
①请完成此实验设计,其中:V1 =____;V6 = ____;V9=____;
②反应一段时间后,实验E中的金属呈____色;
③该同学最后得出结论为:当加入少量硫酸铜溶液时,生成氢气的速率会大大提高,但当加入的硫酸铜溶液超过一定量时,生成氢气的速率反而下降。请分析氢气生成速率下降的主要原因:______________________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com