
【题目】M是一种新型可生物降解的高分子材料,主要制造可降解纤维、塑料和医用材料,其水解最终产物为N.燃烧9.0g的N只产生CO2和H2O,且质量分别为13.2g和5.4g,实验测得N在标准状况下的蒸气密度为4.02g/L;N的核磁共振氢谱显示的峰面积之比为1:1:1:3.
(1)通过计算确定N的分子式
(2)写出由N在催化剂条件下缩聚反应合成M的化学方程式.
【答案】
(1)解:M(N)=4.02g/L×22.4L/mol=90g/mol,n(N)= ![]() =0.1mol/L,
=0.1mol/L,
1molN中:n(C)= ![]() ÷0.1mol=3mol;
÷0.1mol=3mol;
n(H)= ![]() ÷0.1mol=6mol;
÷0.1mol=6mol;
n(O)=(90﹣12×3﹣1×6)÷16=3(mol),
则有机物的分子式为C3H6O3,
答:N的分子式为C3H6O3;
(2)解:N在催化剂条件下缩聚反应合成M,可知N为 ![]() ,M为
,M为 ![]() ,反应的方程式为
,反应的方程式为 ![]() ,
,
答: ![]() .
.
【解析】由密度可确定有机物的相对分子质量,进而计算9.0g有机物的物质的量,计算生成二氧化碳、水的物质的量,确定1mol有机物含有C、H、O的个数,可确定有机物分子式,结合性质确定有机物结构简式,以此解答该题.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应方程式为:
[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3 .
请回答下列问题:
(1)C,N,O的电负性由大到小的顺序为 , 基态Fe原子的价电子排布图为 .
(2)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是 , 与CO互为等电子体的分子的电子式为 .
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是 , 配体中提供孤对电子的原子是 .
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有形成.
a.离子键 b.配位键 c.非极性键 d.δ键
(5)NaAlH4晶体的晶胞如图,
与Na+紧邻且等距的AlH4﹣有个;NaAlH4晶体的密度为gcm﹣3(用含a的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Na2CO3、NaHCO3的性质.回答下列问题:
(1)甲组同学分别取1.0g Na2CO3、NaHCO3固体,各滴加几滴水,发现盛Na2CO3的试管温度上升,而盛NaHCO3的试管温度下降;原因是 .
(2)乙组同学分别取0.1mol/L Na2CO3、0.1mol/LNaHCO3的溶液,用0.1mol/LHCl溶液滴定,pH变化与盐酸体积的关系如图所示: 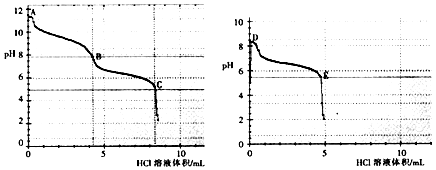
①碳酸钠与盐酸反应pH有两次突变,达到两次反应终点,分别是(填A、B、C、D或E).
②B点的主要溶质是(用化学式表示).
③B点(填“大于”或“小于”) D点的pH,主要原因是 .
(3)丙组同学预测NaHCO3有酸性,向其溶液加入镁粉,发现有气泡和沉淀生成,写出化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下电子排布式不是基态原子的电子排布式的是( )
A.1s22s1
B.1s22s12p1
C.1s22s22p63s2
D.1s22s22p63s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是
A. CuO+2HNO3=Cu(NO3)2+H2O B. FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C. C+4HNO3=CO2↑+2H2O+4NO2↑ D. NH3+HNO3=NH4NO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4 ![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法正确的是( )
A.KClO3在反应中得到电子
B.ClO2是氧化产物
C.H2C2O4在反应中被还原
D.1mol KClO3参加反应有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项操作中,错误的是
A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下口流出,上层液体从上口倒出
C.萃取分液前需对分液漏斗检漏
D.为保证分流漏斗内的液体顺利流出,需将上面的塞子拿下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化剂和还原剂在生产生活中广泛使用.已知高锰酸钾和浓盐酸可以发生如下反应:
2KMnO4+16HCl=5Cl2↑+2MnCl2+2KCl+8H2O
(1)在该反应中还原剂为 , 还原产物为
(2)用双线桥表示该反应中电子转移的方向和数目2KMnO4+16HCl=5Cl2↑+2MnCl2+2KCl+8H2O
(3)若有0.8mol还原剂被氧化,则转移电子的物质的量是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com