
【题目】我国具有悠久的历史,在西汉就有湿法炼铜![]() ,试回答下列问题。
,试回答下列问题。
![]() 基态铜原子最外层电子所占用能级的电子云轮廓图形状为______。
基态铜原子最外层电子所占用能级的电子云轮廓图形状为______。
![]() 黄铁矿
黄铁矿![]() 主要成分
主要成分![]() 是提取硫和制造硫酸的主要矿物原料,产物氧化铁也可以用于炼铁,写出
是提取硫和制造硫酸的主要矿物原料,产物氧化铁也可以用于炼铁,写出![]() 的电子式______。
的电子式______。
![]() 金属铜广泛地应用于电气、机械制造、国防等领域。
金属铜广泛地应用于电气、机械制造、国防等领域。
![]() 受热易分解为
受热易分解为![]() 和
和![]() ,请从铜的原子结构来说明CuO受热易分解的原因:_________
,请从铜的原子结构来说明CuO受热易分解的原因:_________
![]() 向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的
向氯化铜溶液中加入过量浓氨水,然后加入适量乙醇,溶液中析出深蓝色的![]() 晶体。上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______。
晶体。上述深蓝色晶体中含有的化学键除普通共价键外,还有______和______。
![]() 在硫酸铜溶液中加入过量KCN,生成配离子
在硫酸铜溶液中加入过量KCN,生成配离子![]() ,则1mol该配离子中含有的
,则1mol该配离子中含有的![]() 键的数目为_______。
键的数目为_______。
![]() 的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜
的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜![]() 该反应的化学方程式为______,氯化羰基亚铜结构示意图如图。则该化合物中与
该反应的化学方程式为______,氯化羰基亚铜结构示意图如图。则该化合物中与![]() 形成配位键的原子是______。
形成配位键的原子是______。

![]() 金铜合金的一种晶体结构为立方晶型,如图所示:
金铜合金的一种晶体结构为立方晶型,如图所示:

![]() 该合金的化学式为______;
该合金的化学式为______;
![]() 已知该合金的密度为
已知该合金的密度为![]() ,阿伏加德罗常数值为
,阿伏加德罗常数值为![]() ,两个金原子间最小间隙为
,两个金原子间最小间隙为![]() 。则铜原子的半径为______
。则铜原子的半径为______![]() 写出计算表达式
写出计算表达式![]() 。
。
【答案】球形 ![]()
![]() 的最外层电子排布为
的最外层电子排布为![]() ,而
,而![]() 的最外层电子排布为
的最外层电子排布为![]() ,最外层电子排布达到全满时稳定,所以固态
,最外层电子排布达到全满时稳定,所以固态![]() 稳定性强于CuO 离子键 配位键
稳定性强于CuO 离子键 配位键 ![]()
![]() O、Cl、C
O、Cl、C ![]()
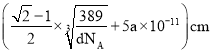
【解析】
![]() 原子最外层电子所占用能级的为4s,电子云轮廓图形状为球形;
原子最外层电子所占用能级的为4s,电子云轮廓图形状为球形;
![]() 由
由![]() 与
与![]() 构成,
构成,![]() 与
与![]() 互为等电子体,二者结构相同;
互为等电子体,二者结构相同;
![]() 的最外层电子排布为
的最外层电子排布为![]() ,而
,而![]() 的最外层电子排布为
的最外层电子排布为![]() ,最外层电子排布达到全满时稳定;
,最外层电子排布达到全满时稳定;
![]() 晶体中
晶体中![]() 、
、![]() 形成离子键,
形成离子键,![]() 中
中![]() 与
与![]() 形成配位键,
形成配位键,![]() 中存在普通共价键;
中存在普通共价键;
![]() 中
中![]() 与
与![]() 形成配位键,配位键属于
形成配位键,配位键属于![]() 键,
键,![]() 中含有1个
中含有1个![]() 键;
键;
![]() 的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜
的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜![]() ;
;
![]() 位于顶点、Cu位于面心;
位于顶点、Cu位于面心;
![]() 根据晶胞进行计算。
根据晶胞进行计算。
![]() 原子核外电子排布式为:
原子核外电子排布式为:![]() ,最外层电子所占用能级的为4s,电子云轮廓图形状为:球形;
,最外层电子所占用能级的为4s,电子云轮廓图形状为:球形;
![]() 由
由![]() 与
与![]() 构成,
构成,![]() 与
与![]() 互为等电子体,二者结构相同,
互为等电子体,二者结构相同,![]() 电子式为:
电子式为:![]() ;
;
![]() 的最外层电子排布为
的最外层电子排布为![]() ,而
,而![]() 的最外层电子排布为
的最外层电子排布为![]() ,最外层电子排布达到全满时稳定,所以固态
,最外层电子排布达到全满时稳定,所以固态![]() 稳定性强于CuO;
稳定性强于CuO;
![]() 晶体中/span>
晶体中/span>![]() 、
、![]() 形成离子键,
形成离子键,![]() 中
中![]() 与
与![]() 形成配位键,
形成配位键,![]() 中存在普通共价键,故答案为:离子键、配位键;
中存在普通共价键,故答案为:离子键、配位键;
![]() 中
中![]() 与
与![]() 形成配位键,配位键属于
形成配位键,配位键属于![]() 键,
键,![]() 中含有1个
中含有1个![]() 键,故
键,故![]() 中含有8个
中含有8个![]() 键,则1mol该配离子中含有的
键,则1mol该配离子中含有的![]() 键的数目为
键的数目为![]() ;
;
![]() 的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜
的盐酸溶液能吸收CO而生成复合物氯化羰基亚铜![]() ,该反应的化学方程式为:
,该反应的化学方程式为:![]() ,氯原子、水中O原子均含有孤电子对,与
,氯原子、水中O原子均含有孤电子对,与![]() 形成配位键,CO中C原子、O原子均哈不要孤对电子,由于O的电负性比C的大,C原子提供孤电子对,形成配位键,
形成配位键,CO中C原子、O原子均哈不要孤对电子,由于O的电负性比C的大,C原子提供孤电子对,形成配位键,
故答案为:![]() ;O、Cl、C;
;O、Cl、C;
![]() 位于顶点、Cu位于面心,晶胞中Au原子数目
位于顶点、Cu位于面心,晶胞中Au原子数目![]() 、Cu原子数目
、Cu原子数目![]() ,故化学式
,故化学式![]() ;
;
![]() 晶胞质量
晶胞质量![]() ,晶胞体积
,晶胞体积 ,则晶胞棱长
,则晶胞棱长![]() ,晶胞棱长
,晶胞棱长![]() 原子之间最小间隙距离
原子之间最小间隙距离![]() 原子直径,故Au原子直径
原子直径,故Au原子直径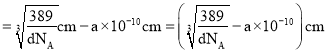 ,晶胞面对角线长度等于晶胞棱长的
,晶胞面对角线长度等于晶胞棱长的![]() 倍,则晶胞面对角线长度
倍,则晶胞面对角线长度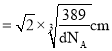 ,而晶胞面对角线长度
,而晶胞面对角线长度![]() 原子直径
原子直径![]() 原子直径,故Cu原子直径
原子直径,故Cu原子直径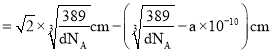 ,故Cu原子半径
,故Cu原子半径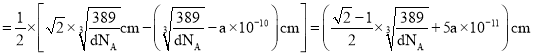 。
。


科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子(就是H+)和水分子通过。其工作原理的示意图如下,请回答下列问题:

(1)该装置的能量转化形式为________。
(2)Pt(a)电极是电池________(填“正”或“负”)极;
(3)电解液中的H+向_____(填“a”或“b”)极移动;
(4)如果该电池工作时消耗1 mol CH3OH,则电路中通过___ mol电子。
(5)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先是燃料电池的能量转化率高,其次是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲基丙烯酸甲酯是合成有机玻璃的单体,其合成方法之一如下:CH3C≡CH+CH3OH+A![]() CH2=C(CH3)COOCH3,下列说法正确的是( )
CH2=C(CH3)COOCH3,下列说法正确的是( )
A.CH3OH和甘油互为同系物
B.已知该反应的原子利用率为100%,则A为CO2
C.CH3C≡CH与丙烯的性质相似,则该物质可以发生加成、氧化反应
D.能与NaHCO3反应的CH2=C(CH3)COOCH3的同分异构体有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构与性质】磷化硼(BP)是一种受关注的耐磨涂层材料,可作为钛等金属表面的保护薄膜。
(1)三溴化硼和三溴化磷混合物在高温条件下与H2反应可以制得BP。
①上述反应的化学方程式为________________________;
②磷原子中存在_____种不同能量的电子,电子占据的最高能层符号为_______。
③常温下,三溴化磷是淡黄色发烟液体,可溶于丙酮、四氯化碳中,该物质属于______晶体(填晶体类型)。
(2)已知磷酸是中强酸,硼酸是弱酸;pKa= -lgKa。
①有机酸的酸性强弱受邻近碳上取代原子的影响,如酸性:BrCH2COOH >CH3COOH。据此推测,pKa:AtCH2COOH____ClCH2COOH(填“>”、“<”、“=”)
②磷酸是三元酸,写出两个与PO43-具有相同空间构型和键合形式的分子或离子_________________。
③硼酸是一元酸,它在水中表现出来的弱酸性,并不是自身电离出氢离子所致,而是水分子与B(OH)3结合,生成一个酸根离子,该阴离子的结构式为:_________(若存在配位键,请用箭头标出)。
(3)高温陶瓷材料Si3N4的成键方式如图1所示,结构中N—Si—N的键角比Si—N—Si的键角大,其原因是_____________________________________。

(4)磷化硼的晶体结构如图2所示。晶胞中P原子的堆积方式为________(填“简单立方”、“体心立方”或“面心立方最密”)堆积。若该晶体中最邻近的两个P原子之间的距离为a nm,则晶体密度为__________g·cm-3(只需列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,水的离子积约为1×10-12,将VaL pH=2的硫酸溶液与VbL pH=11的NaOH溶液混合,若混合溶液的pH=10,体积是(Va+Vb) L,则Va∶Vb为 ( )
A. 2∶11B. 2∶9C. 11∶2D. 9∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中处处可见金属和它们的化合物。
(1)金属钠与水反应后,向其中滴入石蕊试剂,溶液将呈_____色;
(2)已知一种生活中常见的金属,它既可以与盐酸反应也可以与氢氧化钠溶液反应,写出冶炼该金属的化学反应方程式:___________________________________;
(3)将铝棒与铜棒用导线连接,一起放入浓硝酸中,一段时间后,形成了较稳定的电流,则铝为该电池的_____(填电极名称);
(4)铁可以形成多种氧化物,其中常用作红色油漆和涂料的是_____(填化学式);
(5)鉴别三价铁离子和亚铁离子的方法有许多,其中之一就是利用加入酸性高锰酸钾溶液观察其是否褪色来进行判断,请写出该方法涉及的离子反应方程式:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,在一定条件下利用乙烯和水蒸气反应制备乙醇。反应原CH2=CH2(g)+H2O(g)=CH3CH2OH(g )△H。已知几种共价键的键能如下:
化学键 | C-H | C=C | H-O | C-C | C-O |
键能/kJ·mol-1 | 413 | 615 | 463 | 348 | 351 |
下列说法错误的是
A. 上述合成乙醇的反应原子利用率为100%
B. 相同时间段内,用该反应中三种物质表示的该反应的化学反应速率相等
C. 碳碳双键的键能大于碳碳单键键能,但碳碳单键更稳定
D. 上述反应式中,△H=+34kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为_____。又已知:H2O(g)=H2O(l);△H2=﹣44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是___kJ。
(2)已知:2NO2(g)═N2O4(g) △H1 2NO2(g)═N2O4(l) △H2,下列能量变化示意图中,正确的是(选填字母)______。
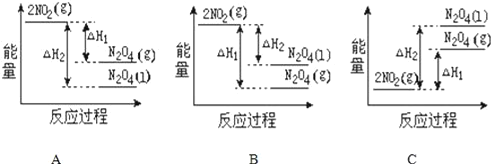
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)═CO2(g) △H1=﹣393.5kJmol﹣1
2H2(g)+O2(g)═2H2O(l) △H2=﹣571.6kJmol﹣1
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l) △H3=﹣2 599kJmol﹣1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:__。
(4)甲醇是一种新型的汽车动力燃料,工业上可通过CO和H2化合来制备甲醇气体(结构简式为CH3OH)。已知某些化学键的键能数据如表:
化学键 | C﹣C | C﹣H | H﹣H | C﹣O | C≡O | H﹣O |
键能/kJmol﹣1 | 348 | 413 | 436 | 358 | 1072 | 463 |
已知CO中的C与O之间为叁键连接,则工业制备甲醇的热化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:
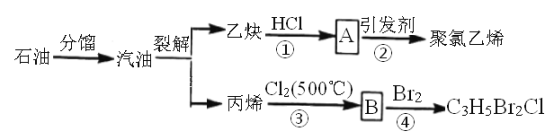
(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com