
 与
与 互为同分异构体
互为同分异构体 与
与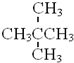 属于同系物
属于同系物 与
与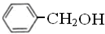 既不是同系物也不是同分异构体.
既不是同系物也不是同分异构体.| A. | ①⑤ | B. | ①④ | C. | ①③⑤ | D. | ①②④ |
分析 ①同位素是质子数相同而中子数不同的同元素的不同原子;
②同素异形体是同种元素组成的性质不同的单质之间的互称;
③同分异构体是具有相同的分子式和不同结构的有机物之间的互称;
④结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物.
解答 解:①126C与136C 具有相同的质子数和不同的中子数的碳原子,互为同位素,故①正确;
②16O是原子,不是单质,故②错误;
③ 与
与 分子式相同,结构相同,是同种物质,故③错误;
分子式相同,结构相同,是同种物质,故③错误;
④ 与
与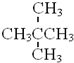 分子式相同,结构不同,互为同分异构体,故④错误;
分子式相同,结构不同,互为同分异构体,故④错误;
⑤羟基直接与苯环相连的是酚,与苯环侧链相连的是醇,结构不相似,不是同系物,故⑤正确;
故选A.
点评 本题考查同位素、同系物、同分异构体、同素异形体的判断,题目难度不大,明确“五同”的概念及区别为解答关键,试题侧重基础知识的考查,有利于提高学生 灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,
某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图所示,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| X | 第三周期元素的简单离子中半径最小 |
| Y | 其最简单氢化物丙的水溶液呈碱性 |
| Z | 原子核外电子数和周期序数相等 |

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通过Na2O2使其增重ag时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ | |
| B. | 将1molCl2通入水中,则 N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| C. | 2.24L的CH4中含有的C-H键数为0.4NA | |
| D. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com