
| A. | 若Z(OH)n为强碱,则W(OH)m也一定为强碱 | |
| B. | 若HnXOm为强酸,则Z的气态氢化物溶于水一定显酸性 | |
| C. | Z可以从W的盐溶液中将W置换出来 | |
| D. | 若Z的最高正价为+3价,则W的氢化物水溶液一定显碱性 |
分析 A.Z、W同周期,原子序数增大,金属性减弱;
B.若HnXOm为强酸,结合原子序数及位置可知,X可能为N,Y为P,Z为S,W为Cl符合;
C.若X为H,Y为Na,W为Al等,钠与盐溶液反应时先与水反应;
D.若Z的最高正价为+3价,则Z为B或Al,W可能为N、O、F等.
解答 解:A.Z、W同周期,原子序数增大,金属性减弱,则若Z(OH)n为强碱,则W(OH)m不一定为强碱,故A错误;
B.若HnXOm为强酸,结合原子序数及位置可知,X可能为N,Y为P,Z为S,W为Cl符合,则的气态氢化物硫化氢溶于水一定显酸性,故B正确;
C.若X为H,Y为Na,W为Al等,钠与盐溶液反应时先与水反应,则Z不能从W的盐溶液中将W置换出来,故C错误;
D.若Z的最高正价为+3价,则Z为B或Al,W可能为N、O、F等,氨气的水溶液显碱性,HF的水溶液显酸性,故D错误;
故选B.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质和元素周期律为解答的关键,侧重分析与应用能力的考查,注意元素的不确定性及元素化合物知识的综合应用,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 0.1mol丙烯酸中含有双键的数目为0.1NA | |
| C. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| D. | 丙烯和环丙烷组成的42g混合气体中氢原子的个数为6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
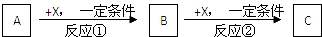
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
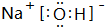 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电负性:④>③>②>① | B. | 最高正化合价:③>①>②>④ | ||
| C. | 原子半径:①>②>③>④ | D. | 第一电离能:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏水湿润的试纸测某溶液的pH,一定会使结果偏低 | |
| B. | 可用酸式滴定管准确量取10.00mLKMnO4溶液 | |
| C. | 在中和热测定实验中,不能用温度计来搅拌溶液 | |
| D. | 将乙烯通入酸性高锰酸钾溶液,可检验乙烯的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
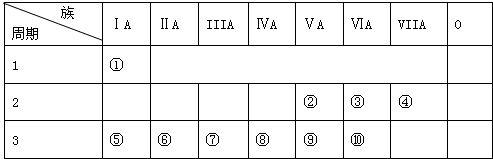
 .
. ,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
,该氢化物的水溶液显碱性(填“酸性”、“碱性”或“中性”),该溶液与少量AlCl3溶液反应的离子方程式:Al3++3NH3•H2O=Al(OH)3↓+3NH4+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何气体都含有相同的原子数 | |
| B. | 1molO2中含有6.02×1023个氧分子 | |
| C. | 1molH2中含有1mol氢原子和2mol电子 | |
| D. | 1molH2SO4中含有6NA个原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com