
【题目】14g铜金合金与足量的某浓度HNO3反应,将产生的气体用2.24L(标准状况)O2混合,通入水中,气体恰好被完全吸收,则合金中铜的质量为( )
A.9.6gB.6.4gC.12.8gD.1.6g
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】一位同学模仿氨碱法,将纯净的CO2通入饱和氨化食盐水中制备固体碳酸氢钠。实验装置如图所示。

(1)乙中盛装的试剂是_________;烧杯(丁)中稀硫酸的作用是_________________________;实验结束后,通过,_________操作分离出NaHCO3晶体。
(2)单独将CO2通入饱和食盐水不可能产生碳酸氢钠沉淀,NH3在此的作用主要基于它的_________性,丙中发生的反应方程式为______________________________________。
(3)将所得NaHCO3洗涤灼烧后得到碳酸钠。验证产品中是否混有NaCl的方法是_________________。
(4)为测定NaHCO3含量,称取5.000g试样,配制成100mL溶液,用标准盐酸滴定,测定数据记录如下:
滴定次数 | 待测液(mL) | 0.5000mol·L-1盐酸的体积(mL) | |
初读数 | 终读数 | ||
第一次 | 20.00 | 1.00 | 21.00 |
第二次 | 20.00 | 如下图 | 如下图 |
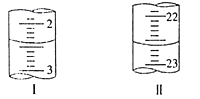
若以甲基橙为指示剂,在滴定终点时的颜色变化为___________________________________,该实验测定NaHCO3含量为w(NaHCO3)=_________(小数点后保留两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲被誉为“现代工业、国防与尖端技术的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某电解精炼铜的阳极泥经预处理后主要含有TeO2和少量Ag、Au,以此预处理阳极泥为原料制备单质碲的一种工艺流程如下:

已知TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO32-。回答下列问题:
(1)阳极泥预处理时发生反应: Cu2Te+O2→CuO+TeO2,Cu2Te中Te的化合价为_____,该反应中氧化剂与还原剂的物质的量之比为_________。
(2)“过滤I”所得滤液中,阴离子主要有_______,要从滤渣1中分离出Au,可以向滤渣中加入的试剂是_________。
(3)步骤②控制溶液的pH为4.5~5.0,反应的化学方程式为________,防止酸度局部过大的操作是____________。
(4)步骤④发生反应的离子方程式是____________。
(5)高纯碲的制备采用电解精炼法。将上述流程得到的粗碲溶于NaOH溶液配成电解液,用适当的电极进行电解,阳极产生的气体是____,阴极上的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁和铝的混合物0.1mol溶于100mL 2 mol/L的H2SO4溶液中,然后滴加1 mol/L的NaOH溶液。在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。请回答:

(1)写出0--V1段直线发生反应的离子方程式________________________________。
(2)a点的沉淀有______________________ 。
(3)若当V1=140mL时,则金属粉末中n(Mg)=______mol,V2=__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温恒容下,向2 L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)![]() MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
MgO(s)+CO2(g)+SO2(g),反应过程中测定的部分数据见下表:
反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(SO2) / mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列说法正确的是
A. 0~2 min内的平均速率为υ (CO)=0.6 mol/(L·min)
B. 4 min后,平衡移动的原因可能是再向容器中加入了2.0 mol的SO2
C. 若升高温度,反应的平衡常数变为1.0,则正反应为放热反应
D. 若其他条件不变,起始时容器中MgSO4、CO均为1.0 mol,则平衡时n(SO2)=0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体![]() 较稳定,呈白色,微溶于水,能溶于酸性溶液
较稳定,呈白色,微溶于水,能溶于酸性溶液![]() 广泛应用于环境杀菌、消毒等领域。
广泛应用于环境杀菌、消毒等领域。
I.过氧化钙晶体的制备工业上生产![]() 的主要流程如下:
的主要流程如下:

(1)用上述方法制取![]() 的化学方程式是 ____________________________________________________。
的化学方程式是 ____________________________________________________。
(2)沉淀时常用冰水控制温度在![]() 以下和通入过量的
以下和通入过量的![]() ,其可能原因分别是
,其可能原因分别是
①___________________________________;②__________________________________________.
II.过氧化钙晶体含量的测定
准确称取![]() 产品于锥形瓶中,加入30mL蒸馏水和
产品于锥形瓶中,加入30mL蒸馏水和![]() ,用
,用![]() 标准溶液滴定至终点
标准溶液滴定至终点![]() 重复上述操作两次。
重复上述操作两次。
③滴定终点观察到的现象为 _______________________________________________________________。
④根据表1数据,计算产品中![]() 的质量分数 ________________________。(保留四位有效数字)
的质量分数 ________________________。(保留四位有效数字)
表![]() 标准溶液滴定数据
标准溶液滴定数据

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)0.2 g H2含有________个H原子。
(2)12.4克Na2X中含有0.4molNa+,则Na2X的摩尔质量是_________。
II.如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
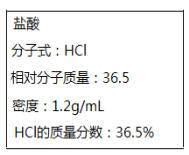
(1)求原浓盐酸的物质的量浓度c=____________。
(2)计算出m=___________。
(3)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学已渗透到人类生活的各个方面。下列说法不正确的是
A. 用聚氯乙烯加工成食品保鲜袋
B. 用纯碱,石灰石和石英制造普通玻调
C. 粮食酿酒经过“淀粉-葡萄糖-乙醇”的化学变化过程
D. 洗涤羊毛织品时不能使用加酶洗衣粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com