
【题目】A、B是两个完全相同的装置,如下图所示,某学生分别在A、B的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别装有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
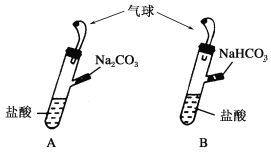
A.A装置的气球膨胀得快
B.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol·L-1
C.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol·L-1
D.最终两试管中Na+、Cl-的物质的量一定相同
【答案】B
【解析】
试题分析:1.06g Na2CO3和0.84g NaHCO3的物质的量都是0.01nol。A、碳酸钠和酸反应分步进行,先生成碳酸氢钠,后碳酸氢钠和酸反应生成二氧化碳,所以A装置的气球膨胀速率小,错误;B、1.06g Na2CO3和0.84g NaHCO3的物质的量相同,若最终两气球体积相同,说明酸的物质的量大于或等于0.02mol,所以其浓度大于或等于2mol/L,正确;C、碳酸钠和酸反应的离子方程式为:CO32-+H+=HCO3-、HCO3-+H+=CO2 ↑+H2O,碳酸氢钠和酸反应的离子方程式为HCO3-+H+=CO2 ↑+H2O;若最终两气球体积不同,所需酸的物质的量范围是:0<酸的物质的量<0.02mol,所以其浓度大于0小于2mol/L,错误;D、1.06g Na2CO3和0.84g NaHCO3的物质的量相同,所以Na2CO3和 NaHCO3中钠离子的物质的量不同,故最终两试管中Na+的物质的量一定不相同,故D错误。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列反应中,不属于取代反应的是 ( )
A. 在催化剂存在条件下苯与液溴反应制溴苯
B. 苯与浓硝酸、浓硫酸混合共热制取硝基苯
C. 苯与浓硫酸共热制取苯磺酸
D. 在一定条件下苯与氢气反应制环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是
A.CO2的比例模型:![]()
B.中子数为18的氯原子的原子符号:18Cl
C.18O2-的结构示意图: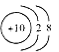
D.N2分子的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g)ΔH=-92.4kJ·mol-1。一种工业合成氨的简式流程图如下:
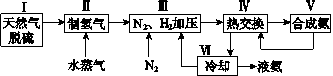
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:_______________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206.4kJ·mol-1
CO(g)+3H2(g)△H=+206.4kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-41.2kJ·mol-1
CO2(g)+H2(g)△H=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是____________。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强
利用反应②,将CO进一步转化,可提高H2的产量。若1molCO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18molCO、CO2和H2的混合气体,则CO的转化率为__________。
(3)图(a)表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)依据温度对合成氨反应的影响,在图(b)坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
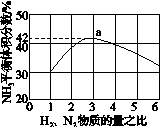
(a)(b)
(5)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。简述本流程中提高合成氨原料总转化率的方法:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与社会、生活有关的说法不正确的是 ( )
A.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
B.减少化石燃料使用,有利于降低空气中PM2.5的值
C.淀粉、豆油、蛋白质都是天然高分子化合物
D.“地沟油”禁止食用,但可以用来制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把100 mL含有CaCl2和KCl的混合溶液分成2等份,取一份加入含amol碳酸钠的溶液,恰好使钙离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
A. 20(b-2a) mol/L B. 10(2a-b) mol/L
C. 20(b-a) mol/L D. 0.1(b-2a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生产钛白的副产品绿矾(FeSO47H2O)制备还原铁粉的步骤如下:将绿矾溶于稀硫酸溶液,向其中滴加(NH4)2CO3溶液,得到FeCO3nH2O沉淀,静置,过滤,洗涤,干燥,再将FeCO3与煤粉一起焙烧,最终制得还原铁粉。涉及的主要反应有:
FeCO3![]() FeO+CO2,
FeO+CO2,
C+CO2![]() 2CO,
2CO,
CO+FeO![]() Fe+CO2,
Fe+CO2,
(1)检验绿矾是否已有部分氧化的方法是 。
(2)证明沉淀已经洗涤干净的方法是 。
(3)干燥过程中少量FeCO3nH2O被氧化为FeOOH,反应方程式为: 。
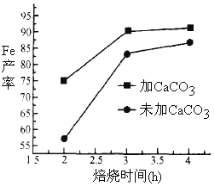
(4)实际生产中,所得沉淀仍含少量硫酸盐,在焙烧过程中需加入CaCO3进行脱硫处理,上图为加CaCO3和不加CaCO3对还原铁粉的产率的影响,根据图像分析,CaCO3的另一作用为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁、铝的混合物进行如下实验:

(1)操作X的名称是___________。
(2)气体A是___________。
(3)加入足量NaOH 溶液时发生反应的离子方程式为______________;加入盐酸发生反应的离子方程式为_______________。
(4)溶液B 中阴离子除OH-外还有_________,溶液D中存在的金属离子为___________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com