
| A. | 对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ/mol(Q>0),若向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量为0.5QkJ | |
| B. | 热化学方程式中的化学计量数表示相应物质的物质的量,不能用分数表示 | |
| C. | 需要加热才能发生的反应不一定是吸热反应 | |
| D. | 小苏打在水中的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
分析 A、2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,该反应为可逆反应,反应物不能完全转化,根据热化学方程式的含义来分析;
B、热化学方程式中的化学计量数表示相应物质的物质的量;
C、反应的吸放热和反应条件之间没有必然的联系;
D、小苏打属于强电解质,在水中可以完全电离.
解答 解:A、2SO2(g)+O2(g)?2SO3(g);△H=-197kJ/mol,该反应为可逆反应,反应物不能完全转化,向一密闭容器中加入1molSO2和0.5molO2充分反应后,放出的热量小于0.5QkJ,故A错误;
B、热化学方程式中的化学计量数表示相应物质的物质的量,能用分数表示,故B错误;
C、需要加热才能发生的反应不一定是吸热反应,如铝热反应是放热反应,但是需要高温条件,故C正确;
D、小苏打属于强电解质,在水中可以完全电离,电离方程式:NaHCO3═Na++HCO3-,故D错误.
故选C.
点评 本题考查学生可逆反应的特点、热化学方程式系数的意义、反应方向和电离方程式的书写知识,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:选择题

| A. | O2中只存在非极性共价键,SO2是共价化合物 | |
| B. | 氧化剂是O2,还原产物只有Fe2O3 | |
| C. | 每消耗22.4LO2,即转移4NA个电子 | |
| D. | SO2溶于水之后的溶液可以导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ($\frac{3m}{2}$+$\frac{n}{2}$+2p)mol | B. | (3p-$\frac{3m}{2}$-$\frac{n}{2}$)mol | C. | 3pmol | D. | ($\frac{3m}{2}$+$\frac{n}{2}$)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
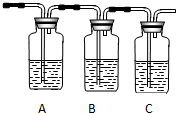 品红溶液 KMnO4 溶液品红溶液 品红溶液 KMnO4 溶液品红溶液 ① |  ② ② | 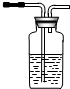 ③ | 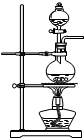 ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol O2与Na完全反应,转移电子数一定为4NA | |
| B. | 22.4 L NH3中含有共价键的数目为3NA | |
| C. | 142 g Na2SO4和Na2HPO4混合物中含有的阴、阳离子总数是3NA | |
| D. | 标准状况下,11.2 L SO3所含的分子数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d,离子的还原性Y2->Z- | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 原子半径X<W,第一电离能X<W | D. | 电负性Z>Y>W>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
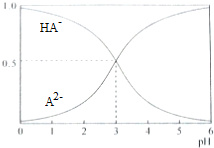 室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )
室温下,1mol/L的某二元酸H2A溶液中,可能存在的含A粒子(H2A,HA-,A2-)的物质的量分数(x)随pH变化的关系下图所示,下列说法正确的是( )| A. | H2A的电离方程式为H2A?H+HA- | |
| B. | 将pH=2的NaHA和Na2A混合溶液中加水稀释10倍,溶液的pH=3 | |
| C. | 将相同物质的量的NaHA和Na2A固体溶于水所得混合溶液的pH一定为3 | |
| D. | Na2A溶液存在:c(0H-)=c(H+)+c(HA-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
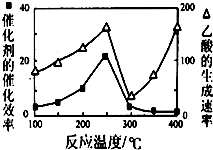 利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:
利用CH4和CO2可以制造价值更高的化学产品.已知下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com