

 CH3OH(g)
CH3OH(g)| 时间/浓度 | c(CO)(mol/L) | C(H2 )(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4 min | a | b | c |
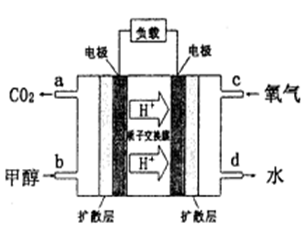
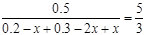 ,解得:x=0.100。(4)负极发生氧化反应,正极发生还原反应,正极的电极反应式:O2+4e-+4H+=2H2O,故正极的pH值增大。
,解得:x=0.100。(4)负极发生氧化反应,正极发生还原反应,正极的电极反应式:O2+4e-+4H+=2H2O,故正极的pH值增大。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
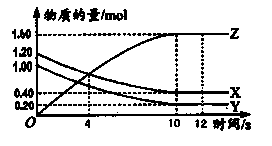
| A.反应为 X + 2Z= Y |
B.反应为 X + Y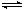 2Z 2Z |
| C.4 s 时,反应达到平衡 |
| D.12 s 时,反应不再进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 zC(g) △H<0。
zC(g) △H<0。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
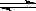 C(g)+ D(g)已达到平衡的是
C(g)+ D(g)已达到平衡的是 | A.混合气体的压强 | B.混合气体的分子数目 |
| C.混合气体的密度 | D.混合气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。
2SO3(g)。反应达平衡时,测得容器内n(SO3)=1.3mol,n(O2)=3.0mol。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( )
2C(g),在2min后反应达到平衡时,测得混合气体共3.4moL,生成0.4moLC, 则下列计算结果不正确的是( )| A.平衡时,物质的量之比A︰B︰C=2︰11︰4 |
| B.x值等于4 |
| C.A的转化率为20% |
| D.平衡时B的平均反应速率为0.04moL/(L·min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
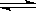 H2(g) + I2(g),达到 平衡状态的标志是
H2(g) + I2(g),达到 平衡状态的标志是 | A.I2(g)的消耗速率等于H2的消耗速率 |
| B.容器中各组分的浓度不随时间变化 |
| C.容器内气体的压强不再变化 |
| D.单位时间内生成n mol H2,同时生成n mol HI |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
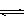 3M + N ;△H<0,其中A.B.M.N均为气态, 在一定条件下达到平衡后, A 在反应混合物中的百分含量为 a% , 若要通过改变条件使 a% 改变为 2a%, 那么下列各项可以改变的条件中应选择的是:
3M + N ;△H<0,其中A.B.M.N均为气态, 在一定条件下达到平衡后, A 在反应混合物中的百分含量为 a% , 若要通过改变条件使 a% 改变为 2a%, 那么下列各项可以改变的条件中应选择的是: 查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
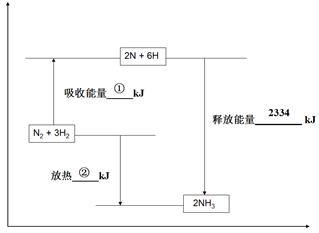
 2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程)
2NH3(g);△H=-92.2kJ·mol-1。平衡时容器内气体压强为起始时的80%。(写出计算过程) CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)
CH3OH(g),经过5 min后达到平衡状态。若此时测得CH3OH蒸气的浓度为2 mol/L,求:(写出计算过程)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com