
[s1]  ŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±µ„¶ĄøıäæÉÄę·“Ó¦£ŗN2(g)+3H2(g)
2NH3(g)£»”÷H<0µÄijŅ»Ģõ¼žŗó£¬ĻĀĮŠŠšŹöÖŠ“ķĪóµÄŹĒ £Ø £©
ŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±µ„¶ĄøıäæÉÄę·“Ó¦£ŗN2(g)+3H2(g)
2NH3(g)£»”÷H<0µÄijŅ»Ģõ¼žŗó£¬ĻĀĮŠŠšŹöÖŠ“ķĪóµÄŹĒ £Ø £©
A£®¼ÓČė“߻ƼĮ£¬VÕż”¢VÄę¶¼·¢Éś±ä»Æ£¬ĒŅ±ä»ÆµÄ±¶ŹżĻąµČ
B£®Ōö“óŃ¹Ē棬VÕż”¢VÄę¶¼Ōö“ó£¬VÕżŌö“óµÄ±¶Źż“óÓŚVÄęŌö“óµÄ±¶Źż
C£®½µµĶĪĀ¶Č£¬VÕż”¢VÄę¶¼¼õŠ”£¬ĒŅVÕż¼õŠ”µÄ±¶ŹżŠ”ÓŚVÄę¼õŠ”µÄ±¶Źż
D£®¼ÓČėė²Ęų£¬VÕż”¢VÄę¶¼Ōö“ó£¬ĒŅVÕżŌö“óµÄ±¶Źż“óÓŚVÄęŌö“óµÄ±¶Źż
[s1]7£®
 ĒÉѧĒÉĮ·ĻµĮŠ“š°ø
ĒÉѧĒÉĮ·ĻµĮŠ“š°ø æĪæĪĮ·½ĖÕĻµĮŠ“š°ø
æĪæĪĮ·½ĖÕĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŌĶĮĄķ½ā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2013½ģŗÓÄĻŹ”·ö¹µĻŲøß¼¶ÖŠŃ§øßČżµŚČż“Īæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø“ų½āĪö£© ĢāŠĶ£ŗĢīæÕĢā
(11·Ö)ŅŌCO2ĪŖĢ¼Ō“ÖĘČ”µĶĢ¼ÓŠ»śĪļ³ÉĪŖ¹ś¼ŹŃŠ¾æ½¹µć£¬ĻĀĆęĪŖCO2¼ÓĒāÖĘČ”µĶĢ¼“¼µÄČČĮ¦Ń§Źż¾Ż£ŗ
·“Ó¦I£ŗ CO2(g)+3H2(g) CH3OH(g)+H2O(g) ”÷H = ”Ŗ49.0 kJ”¤mol-1
CH3OH(g)+H2O(g) ”÷H = ”Ŗ49.0 kJ”¤mol-1
·“Ó¦II£ŗ2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ”÷H =" ”Ŗ173.6" kJ”¤mol-1
CH3CH2OH(g)+3H2O(g) ”÷H =" ”Ŗ173.6" kJ”¤mol-1
(1)Š“³öÓÉCH3CH2OH+_____ 2CH3OHµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ__________________”£
2CH3OHµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ__________________”£
(2)ŌŚŅ»¶ØĢõ¼žĻĀ£¬¶ŌÓŚ·“Ó¦I£ŗŌŚĢå»żŗć¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ__ (Ģī×ÖÄø)
a£®CO2ŗĶCH3OH ÅضČĻąµČ””””””””””b£®H2OµÄ°Ł·Öŗ¬Įæ±£³Ö²»±ä
c£®H2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0”””””””” d£®vÕż(CO2)=3vÄę(H2)””
e.»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ·¢Éśøıä
f. »ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ·¢Éśøıä
Čē¹ūĘ½ŗā³£ŹżKÖµ±ä“ó£¬øĆ·“Ó¦””””””””””””””””””(Ģī×ÖÄø)
a£®Ņ»¶ØĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”””””” b£®ŌŚĘ½ŗāŅĘ¶ÆŹ±Õż·“Ó¦ĖŁĀŹĻČŌö“óŗó¼õŠ”
c£®Ņ»¶ØĻņÄę·“Ó¦·½ĻņŅĘ¶Æ”””””” d£®ŌŚĘ½ŗāŅĘ¶ÆŹ±Äę·“Ó¦ĖŁĀŹĻČ¼õŠ”ŗóŌö“ó
ĘäĖūĢõ¼žŗć¶Ø£¬Čē¹ūĻėĢįøßCO2µÄ·“Ó¦ĖŁĀŹ£¬æÉŅŌ²ÉČ”µÄ·“Ó¦Ģõ¼žŹĒ (Ģī×ÖÄø) £¬
“ļµ½Ę½ŗāŗó£¬ĻėĢįøßH2×Ŗ»ÆĀŹµÄŹĒ_______________(Ģī×ÖÄø)
a”¢½µµĶĪĀ¶Č b”¢²¹³äH2 c”¢ŅĘČ„¼×“¼ d”¢¼ÓČė“߻ƼĮ
£Ø3£©ŌŚĆܱÕČŻĘ÷ÖŠ£¬¶ŌÓŚ·“Ó¦IIÖŠ£¬ŃŠ¾æŌ±ŅŌÉś²śŅŅ“¼ĪŖŃŠ¾æ¶ŌĻó£¬ŌŚ5MPa”¢m= n(H2)/n(CO2)=3Ź±£¬²āµĆ²»Ķ¬ĪĀ¶ČĻĀĘ½ŗāĢåĻµÖŠø÷ÖÖĪļÖŹµÄĢå»ż·ÖŹż£Øy%£©ČēĶ¼ĖłŹ¾£¬Ōņ±ķŹ¾CH3CH2OHĢå»ż·ÖŹżĒśĻߵďĒ £»±ķŹ¾CO2µÄĢå»ż·ÖŹżĒśĻߵďĒ ”£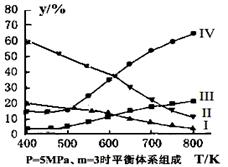
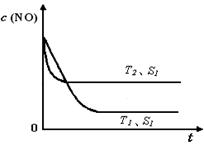
£Ø4£©µ±ÖŹĮæŅ»¶ØŹ±£¬Ōö“ó¹ĢĢå“߻ƼĮµÄ±ķĆ껿æÉĢįøß»Æѧ·“Ó¦ĖŁĀŹ”£ÉĻĶ¼ŹĒ·“Ó¦£ŗ2NO(g) + 2CO(g) 2CO2(g)+ N2(g) ÖŠNOµÄÅضČĖęĪĀ¶Č(T)”¢“߻ƼĮ±ķĆ껿(S)ŗĶŹ±¼ä(t)µÄ±ä»ÆĒśĻߣ¬Čō“߻ƼĮµÄ±ķĆ껿S1£¾S2 £¬ŌŚÉĻĶ¼ÖŠ»³öNOµÄÅضČŌŚT1”¢S2 Ģõ¼žĻĀ“ļµ½Ę½ŗā¹ż³ĢÖŠµÄ±ä»ÆĒśĻߣ¬²¢×¢Ć÷Ģõ¼ž”£
2CO2(g)+ N2(g) ÖŠNOµÄÅضČĖęĪĀ¶Č(T)”¢“߻ƼĮ±ķĆ껿(S)ŗĶŹ±¼ä(t)µÄ±ä»ÆĒśĻߣ¬Čō“߻ƼĮµÄ±ķĆ껿S1£¾S2 £¬ŌŚÉĻĶ¼ÖŠ»³öNOµÄÅضČŌŚT1”¢S2 Ģõ¼žĻĀ“ļµ½Ę½ŗā¹ż³ĢÖŠµÄ±ä»ÆĒśĻߣ¬²¢×¢Ć÷Ģõ¼ž”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğŗÓÄĻŹ”øßČżµŚČż“Īæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(11·Ö)ŅŌCO2ĪŖĢ¼Ō“ÖĘČ”µĶĢ¼ÓŠ»śĪļ³ÉĪŖ¹ś¼ŹŃŠ¾æ½¹µć£¬ĻĀĆęĪŖCO2¼ÓĒāÖĘČ”µĶĢ¼“¼µÄČČĮ¦Ń§Źż¾Ż£ŗ
·“Ó¦I£ŗ
CO2(g)+3H2(g) CH3OH(g)+H2O(g)
”÷H = ”Ŗ49.0 kJ”¤mol-1
CH3OH(g)+H2O(g)
”÷H = ”Ŗ49.0 kJ”¤mol-1
·“Ó¦II£ŗ2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g)
”÷H = ”Ŗ173.6 kJ”¤mol-1
CH3CH2OH(g)+3H2O(g)
”÷H = ”Ŗ173.6 kJ”¤mol-1
(1)Š“³öÓÉCH3CH2OH +_____ 2CH3OHµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ__________________”£
2CH3OHµÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ__________________”£
(2)ŌŚŅ»¶ØĢõ¼žĻĀ£¬¶ŌÓŚ·“Ó¦I£ŗŌŚĢå»żŗć¶ØµÄĆܱÕČŻĘ÷ÖŠ£¬“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ__ (Ģī×ÖÄø)
a£®CO2ŗĶCH3OH ÅضČĻąµČ”””” ””””””b£®H2OµÄ°Ł·Öŗ¬Įæ±£³Ö²»±ä
c£®H2µÄĘ½¾ł·“Ó¦ĖŁĀŹĪŖ0”””” ”””” d£®vÕż(CO2)=3vÄę(H2)””
e.»ģŗĻĘųĢåµÄĆÜ¶Č²»ŌŁ·¢Éśøıä
f. »ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ²»ŌŁ·¢Éśøıä
Čē¹ūĘ½ŗā³£ŹżKÖµ±ä“ó£¬øĆ·“Ó¦””””””””””””””””””(Ģī×ÖÄø)
a£®Ņ»¶ØĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”””””” b£®ŌŚĘ½ŗāŅĘ¶ÆŹ±Õż·“Ó¦ĖŁĀŹĻČŌö“óŗó¼õŠ”
c£®Ņ»¶ØĻņÄę·“Ó¦·½ĻņŅĘ¶Æ”””””” d£®ŌŚĘ½ŗāŅĘ¶ÆŹ±Äę·“Ó¦ĖŁĀŹĻČ¼õŠ”ŗóŌö“ó
ĘäĖūĢõ¼žŗć¶Ø£¬Čē¹ūĻėĢįøßCO2µÄ·“Ó¦ĖŁĀŹ£¬æÉŅŌ²ÉČ”µÄ·“Ó¦Ģõ¼žŹĒ (Ģī×ÖÄø) £¬
“ļµ½Ę½ŗāŗó£¬ĻėĢįøßH2×Ŗ»ÆĀŹµÄŹĒ_______________(Ģī×ÖÄø)
a”¢½µµĶĪĀ¶Č b”¢²¹³äH2 c”¢ŅĘČ„¼×“¼ d”¢¼ÓČė“߻ƼĮ
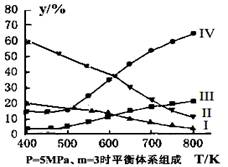
£Ø3£©ŌŚĆܱÕČŻĘ÷ÖŠ£¬¶ŌÓŚ·“Ó¦IIÖŠ£¬ŃŠ¾æŌ±ŅŌÉś²śŅŅ“¼ĪŖŃŠ¾æ¶ŌĻó£¬ŌŚ5MPa”¢m= n(H2)/n(CO2)=3Ź±£¬²āµĆ²»Ķ¬ĪĀ¶ČĻĀĘ½ŗāĢåĻµÖŠø÷ÖÖĪļÖŹµÄĢå»ż·ÖŹż£Øy%£©ČēĶ¼ĖłŹ¾£¬Ōņ±ķŹ¾CH3CH2OHĢå»ż·ÖŹżĒśĻߵďĒ £»±ķŹ¾CO2µÄĢå»ż·ÖŹżĒśĻߵďĒ ”£
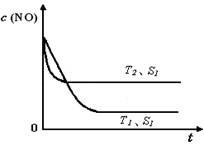
£Ø4£©µ±ÖŹĮæŅ»¶ØŹ±£¬Ōö“ó¹ĢĢå“߻ƼĮµÄ±ķĆ껿æÉĢįøß»Æѧ·“Ó¦ĖŁĀŹ”£ÉĻĶ¼ŹĒ·“Ó¦£ŗ2NO(g)
+ 2CO(g)
 2CO2(g)+ N2(g) ÖŠNOµÄÅضČĖęĪĀ¶Č(T)”¢“߻ƼĮ±ķĆ껿(S)ŗĶŹ±¼ä(t)µÄ±ä»ÆĒśĻߣ¬ Čō“߻ƼĮµÄ±ķĆ껿S1£¾S2 £¬ŌŚÉĻĶ¼ÖŠ»³öNOµÄÅضČŌŚT1”¢S2 Ģõ¼žĻĀ“ļµ½Ę½ŗā¹ż³ĢÖŠµÄ±ä»ÆĒśĻߣ¬²¢×¢Ć÷Ģõ¼ž”£
2CO2(g)+ N2(g) ÖŠNOµÄÅضČĖęĪĀ¶Č(T)”¢“߻ƼĮ±ķĆ껿(S)ŗĶŹ±¼ä(t)µÄ±ä»ÆĒśĻߣ¬ Čō“߻ƼĮµÄ±ķĆ껿S1£¾S2 £¬ŌŚÉĻĶ¼ÖŠ»³öNOµÄÅضČŌŚT1”¢S2 Ģõ¼žĻĀ“ļµ½Ę½ŗā¹ż³ĢÖŠµÄ±ä»ÆĒśĻߣ¬²¢×¢Ć÷Ģõ¼ž”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
[s1] ![]() ŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±µ„¶ĄøıäæÉÄę·“Ó¦£ŗN2(g)+3H2(g) 2NH3(g)£»”÷H<0µÄijŅ»Ģõ¼žŗó£¬ĻĀĮŠŠšŹöÖŠ“ķĪóµÄŹĒ £Ø £©
ŌŚŅ»¶ØĢõ¼žĻĀ£¬µ±µ„¶ĄøıäæÉÄę·“Ó¦£ŗN2(g)+3H2(g) 2NH3(g)£»”÷H<0µÄijŅ»Ģõ¼žŗó£¬ĻĀĮŠŠšŹöÖŠ“ķĪóµÄŹĒ £Ø £©
A£®¼ÓČė“߻ƼĮ£¬VÕż”¢VÄę¶¼·¢Éś±ä»Æ£¬ĒŅ±ä»ÆµÄ±¶ŹżĻąµČ
B£®Ōö“óŃ¹Ē棬VÕż”¢VÄę¶¼Ōö“ó£¬VÕżŌö“óµÄ±¶Źż“óÓŚVÄęŌö“óµÄ±¶Źż
C£®½µµĶĪĀ¶Č£¬VÕż”¢VÄę¶¼¼õŠ”£¬ĒŅVÕż¼õŠ”µÄ±¶ŹżŠ”ÓŚVÄę¼õŠ”µÄ±¶Źż
D£®¼ÓČėė²Ęų£¬VÕż”¢VÄę¶¼Ōö“ó£¬ĒŅVÕżŌö“óµÄ±¶Źż“óÓŚVÄęŌö“óµÄ±¶Źż
[s1]7£®
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com