
【题目】【题目】某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成碳族元素中C与Si的非金属性强弱比较的实验研究;乙同学设计了如图2装置来验证卤族元素性质的递变规律。A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)写出对应装置中选用的物质:A______________________,B________________,C________________;
(2)其中装置B中所盛试剂的作用为___________________;C中反应的离子方程式为_______________________________。
(3)乙同学的实验原理是________________________________________________;写出B处的离子方程式:________________________________。
【答案】 石灰石(CaCO3) 饱和NaHCO3溶液 Na2SiO3溶液 除去CO2中的HCl气体 SiO+2CO2+2H2O===H2SiO3↓+2HCO-(CO2过量) 强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质 2I-+Cl2===2Cl-+I2、Br2+2I-===I2+2Br-
【解析】试题分析:通过比较酸性强弱来判断非金属性强弱,完成C与Si的非金属性强弱比较的实验,A装置制取二氧化碳,B装置除去二氧化碳中的氯化氢,C装置硅酸钠与二氧化碳反应证明碳酸的酸性大于硅酸;乙通过比较单质的氧化性来判断非金属性。
解析:根据以上分析,(1). 完成C与Si的非金属性强弱比较的实验,A装置制取二氧化碳,B装置除去二氧化碳中的氯化氢,C装置硅酸钠与二氧化碳反应证明碳酸的酸性大于硅酸;装置中选用的物质:A中放石灰石,B中盛放饱和NaHCO3溶液,C中盛放Na2SiO3溶液;(2)装置B中盛饱和NaHCO3溶液的作用是除去CO2中的HCl气体;C中硅酸钠与过量二氧化碳反应生成硅酸沉淀和碳酸氢钠,离子方程式为SiO+2CO2+2H2O===H2SiO3↓+2HCO-;(3)乙同学通过比较单质的氧化性来判断非金属性,实验原理是强氧化剂生成弱氧化剂或活泼的非金属单质置换较不活泼的非金属单质,B处参与反应的气体有氯气和A处生成的溴蒸气,氯气与碘化钾反应生成氯化钾和碘单质的离子方程式是2I-+Cl2===2Cl-+I2,溴与碘化钾反应生成溴化钾和碘单质的离子方程式是Br2+2I-===I2+2Br-


科目:高中化学 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件或反应物用量的改变,对生成物没有影响的是( )
A. Na2O2和CO2B. Na和O2C. Fe和O2D. C和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣
B.c(AlO2﹣)=0.1 mol?L﹣1的溶液中:Na+、K+、HCO3﹣、Cl﹣
C.![]() =1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
=1×10﹣13mol?L﹣1的溶液中:NH4+、Ca2+、Cl﹣、NO3﹣
D.水电离的c(H+)=1×10﹣13mol?L﹣1的溶液中:K+、Na+、AlO2﹣CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2的离子化合物。
(1)写出Y2O2的电子式:____ _,其中含有的化学键是___ _。
(2)用电子式表示Y2O的形成过程________ _______。
(3)X、Z、W三种元素的最高价氧化物对应的水化物中,稀溶浓氧化性最强的是_____(填化学式)。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是__________(填化学式)。
(5)由X、Y组成的化合物分子中.X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式_______________ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~F的转化关系如下: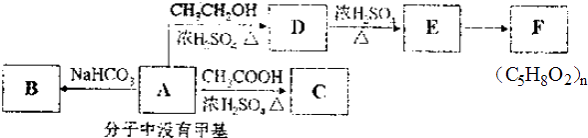
请回答下列问题:
(1)有机物A的相对分子质量为90,9.0gA和足量的金属Na反应,在标准状况下能生成2.24L的H2 , 则A的分子式为;
(2)C的结构简式为 , 由E生成F的反应类型是;
(3)写出由D直接生成E的化学方程式为;
(4)写出与A具有相同官能团的A的同分异构体的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.氢氧化钡溶液与稀硫酸反应:Ba2++SO ![]() +H++OH﹣=BaSO4↓+H2O
+H++OH﹣=BaSO4↓+H2O
B.淀粉碘化钾溶液在空气中变蓝:4I﹣+O2+2H2O=4OH﹣+2I2
C.磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O
D.用氨水吸收足量的SO2气体:OH﹣+SO2=HSO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 在水溶液或熔融状态下能够导电的物质是电解质
B. 分解反应,都是氧化还原反应
C. 金属易导热、易导电、有延展性
D. 在溶液中能够电离出氢离子的物质是酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯、丙烯都是石油裂解的产物之一,回答下列问题:
(1)乙烯能使溴水褪色,写出其反应的化学方程式;
(2)在一定条件下,丙烯除了与氯化氢、氢气等发生反应外,丙烯分子间还可以发生加聚反应,请写出其反应的化学方程式 , 丙烯发生加聚反应得到的产物(填:“能”“不能”)使酸性KMnO4溶液褪色,丙烯分子中能够共平面的原子最多为个.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com