
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1135.7 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、X、W、U的最高价氧化物对应的水化物酸性由强到弱的顺序为:U>W>X |
| B、Y、Z元素的单质作电极,在NaOH溶液中构成原电池,Z电极上产生大量气泡 |
| C、室温下,0.05 mol/L U的气态氢化物的水溶液的pH>1 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | ||
| C | B |
| A、A元素的最高正价为+6价 |
| B、A、B、C依次是氧、氯、磷 |
| C、B元素的单质常温下是一种黄绿色气体 |
| D、C单质常用来制作计算机的芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:
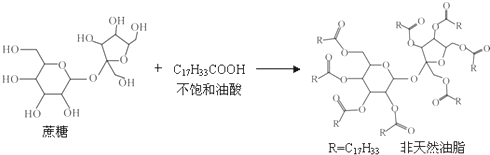
| A、该非天然油脂含有碳碳双键,具有酯类的结构 |
| B、该非天然油脂与氢氧化钠溶液共热,水解后的产物,可与溴的四氯化碳溶液反应 |
| C、蔗糖分子结构中不含醛基,是非还原性糖,不能直接与银氨溶液发生银镜反应 |
| D、油酸与蔗糖的反应属于皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某中学环境监测兴趣小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如右图所示.这些厂往小河里排放的废水中各含一种化合物.经检测发现:①甲处河水呈浅黄色;②乙处河水呈红褐色浑浊状;③丙处河水逐渐变澄清;④丁处河水不断冒气泡;⑤M处水样的pH大于7,加入足量的稀HNO3后再加入BaCl2溶液,无沉淀生成;⑥N处水样的pH小于7.请回答:
某中学环境监测兴趣小组的同学在一条鱼虾绝迹的小河边发现四个工厂,如右图所示.这些厂往小河里排放的废水中各含一种化合物.经检测发现:①甲处河水呈浅黄色;②乙处河水呈红褐色浑浊状;③丙处河水逐渐变澄清;④丁处河水不断冒气泡;⑤M处水样的pH大于7,加入足量的稀HNO3后再加入BaCl2溶液,无沉淀生成;⑥N处水样的pH小于7.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、77.6 kJ |
| B、-77.6 kJ?mol-1 |
| C、+77.6kJ?mol-1 |
| D、-886.8kJ?mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com