
【题目】实验室用浓盐酸和 MnO2 制 Cl2,并以氯气为原料制备氯化铁,已知氯化铁容易与水发生水解反应,装 置如下图所示。
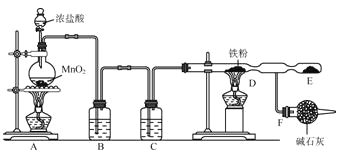
(1)装置 A 烧瓶中发生反应的化学方程式为:______________。
(2)装置 B、C 中应盛放的试剂名称分别为___________、________________若装置去掉 B、C,将对实验产生的安全隐患是_____________
(3)实验时,先点燃 A 处的酒精灯,让氯气充满装置,再点燃 D 处酒精灯,写出 D 中反应的化学方程式:_____。
(4)F 装置所起的作用是_____,_____。
(5)用廉价的石灰乳吸收氯气可制得漂粉精,写出工业制漂粉精反应的化学方程式:____________。
【答案】MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 HCl 和水蒸气进入 D 中与铁反应生成 H2,H2 和 Cl2 混合加热易发生爆炸 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 饱和食盐水 浓硫酸 HCl 和水蒸气进入 D 中与铁反应生成 H2,H2 和 Cl2 混合加热易发生爆炸 2Fe+3Cl2![]() 2FeCl3 吸收多余的氯气,防止其逸出污染环境 防止空气中的水蒸气进入 D 中 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2FeCl3 吸收多余的氯气,防止其逸出污染环境 防止空气中的水蒸气进入 D 中 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
(1)二氧化锰与浓盐酸在加热条件下反应生成二氯化锰和氯气、水,据此写出方程式;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢,需用饱和食盐水除去氯化氢,用浓硫酸吸收水蒸气;若没有这两步操作,盐酸与铁反应产生的氢气与氯气混合受热会发生爆炸;
(3)铁粉与氯气在加热条件下反应生成氯化铁;
(4)反应后剩余的氯气需要吸收,空气中的水蒸气不能进入D装置内,影响实验,据此分析碱石灰的作用。
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,据此写出方程式;
(1)二氧化锰与浓盐酸在加热条件下反应生成二氯化锰和氯气、水,方程式为:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
故答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)浓盐酸具有挥发性,所以混合气体中含有氯化氢,氯化氢易溶于水,氯气难溶于饱和食盐水,所以选饱和食盐水除去氯化氢;因题中要求制备氯化铁,所以要除去氯气中混有的水蒸气,且不引进新的杂质、氯气也和该物质不反应,所以选浓硫酸;因浓盐酸具有挥发性,反应生成物中有水,在加热条件下变成水蒸气,所以混合气体中的成分是氯化氢、水蒸气、氯气,氯化氢和铁能反应生成氢气,氢气和氯气混合会发生爆炸;
故答案是:饱和食盐水;浓硫酸;HCl 和水蒸气进入 D 中与铁反应生成 H2,H2 和 Cl2 混合加热易发生爆炸;
(3)铁粉与氯气在加热条件下反应生成氯化铁,方程式为:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
故答案是:2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(4)氯气有毒,污染环境,所以不能排空,碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应,所以可用碱石灰处理尾气,空气中有水蒸气,碱石灰还能吸收水蒸气,所以可作干燥剂,防止水蒸气进行D装置干扰实验;
故答案是:吸收多余的氯气,防止其逸出污染环境;防止空气中的水蒸气进入 D 中;
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。


科目:高中化学 来源: 题型:
【题目】把镁条直接投入到盛有盐酸的敞口容器中,产生H2的速率如图所示,
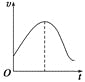
在下列因素中,影响反应速率的因素是
①盐酸的浓度 ②镁条的表面积 ③溶液的温度 ④Cl-的浓度
A. ①④B. ③④C. ①②③D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是
①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
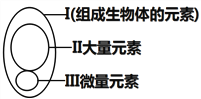
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Fe属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的化工原料。下列有关说法错误的是( )
A. 苯乙烯可发生加聚反应 B. 苯乙烯在一定条件下可与液溴发生取代反应
C. 苯乙烯分子中所有碳原子一定共平面 D. 苯乙烯的苯环上的一氯代物有3 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
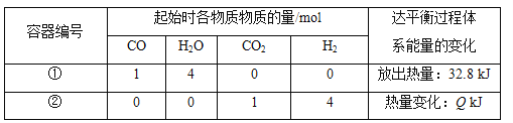
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 平衡时,两容器中CO2的浓度相等
D. 容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2与NaOH溶液反应可生成NaCl、NaClO和NaClO3(Cl-和ClO-)的比值与反应的温度有关,用24gNaOH配成的250mL溶液,与Cl2恰好完全反应(忽略Cl2与水的反应、盐类的水解及溶液体积变化):
(1)NaOH溶液的物质的量浓度_____mol·L-1;
(2)某温度下,反应后溶液中c(Cl-)=6c(ClO-),则溶液中c(ClO-) =_____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸(H3BO3)为一元弱酸,广泛用于玻璃、医药、冶金、皮革等工业。回答下列问题:
(1) H3BO3中B元素的化合价为______,其在元素周期表的位置是_________________。
(2)已知:A(OH)3+H2O![]() [Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
[Al(OH)4]-+H+,H3BO3的电离方程式为_______。酸性:H3BO3 _____(填*>”或“<”)Al(OH)3。
(3) H3BO3受热分解得到的B2O3和镁粉混合点燃可得单质B,生成单质B的化学方程式为________。
(4) H3BO3可用于生产储氢材料NaBH4。涉及的主要反应为:
I.H3BO3+3CH3OH→B(OCH3)3+3H2O
II.B(OCH3)3+4NaH→NaBH4+3CH3ONa
①“反应I”的类型为__________(填标号)。
A.取代反应 B.加成反应 C.加聚反应 D.氧化反应
②NaH的电子式为_______________。
③在碱性条件下,NaBH4与CuSO4溶液反应可得Cu和Na[B(OH)4],其中H元素由-1价升高为+1价,该反应的离子方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁在空气中易被氧化,与硫酸铵反应生成硫酸亚铁铵[化学式为FeSO4·(NH4)2SO4·6H2O]后就不易被氧化。模拟工业制备硫酸亚铁铵晶体的实验装置如下图所示。请回答下列问题:
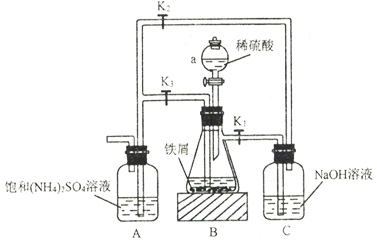
(1)仪器a的名称是______________________。
(2)铁屑中常含有Fe2O3、FeS等杂质,则装置C的作用是___________,装置B中发生反应的离子方程式可能是___________(填序号)。
A .Fe+2H+=Fe2++H2↑
B. Fe2O3+6H+=2Fe3++3H2O
C.2Fe3++S2-=2Fe2++S↓
D.2Fe3++Fe=2Fe2+
(3)按上图连接好装置,经检验气密性良好后加入相应的药品,打开K1、K2,关闭K3,装置B中有气体产生,该气体的作用是___________。反应一段时间后,打开K3,关闭K1和K2。装置B中的溶液会流入装置A,其原因是______________________。
(4)按上图所示装置制备硫酸亚铁铵晶体的安全隐患是______________________。
(5)根据相关物质的溶解度判断,从装置A中分离出硫酸亚铁铵晶体,需采用的操作有___________、___________、洗涤、干燥。
三种盐的溶解度(单位为g/100gH2O)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com