
分析 ①升高温度,平衡向正反应方向移动,气体物质的量增大;
②积增大一倍时,P(Br2)降为原来的一半,减压使平衡向气体体积数增大的方向移动,压强又增大,若反应物足量,平衡恢复到原有的压强.
解答 解:①升高温度,平衡向吸热反应方向移动,气体的物质的量增大,因而P(Br2)会增大,
故答案为:增大;
②体积增大一倍时,P(Br2)降为原来的一半,即2.33×103Pa,减压使平衡向气体体积数增大的方向移动,因而会大于2.33×103Pa;若反应物足量,可平衡恢复到原有的P(Br2),
故答案为:2.33×103Pa<P(Br2)≤4.66×103Pa.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):
反应A+B?2C,其中A为有色气态物质,其混合物颜色深浅与反应时间、温度(t)之间的关系如图所示(B、C均为无色物质):查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
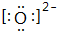 ;
;| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NA | |
| B. | 1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子 | |
| C. | 由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NA | |
| D. | 6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中硫元素只被氧化 | |
| B. | Na2S2O3在强酸性环境中能稳定存在 | |
| C. | 每生成1 molNa2S2O3,转移电子数为4NA | |
| D. | 若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成3mol Na2S2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com