
【题目】金银花中能提取出有很高药用价值的绿原酸(如图所示),下列说法不正确的是( )
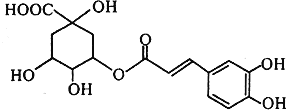
A. 绿原酸分子中有3个手性碳原子
B. 绿原酸能发生取代、加成、消去和氧化反应
C. 1mol绿原酸与NaOH溶液反应,最多消耗4mol NaOH
D. 绿原酸水解的一种产物能与FeCl3发生显色反应
科目:高中化学 来源: 题型:
【题目】NaCl是一种化工原料,可以制备一系列物质,如图所示。

请回答下列问题:
(1)上述流程框图中属于电解质且存在熔融态导电的是________,属于非电解质的是_______。
(2)H2和Cl2的反应属于______________________(填字母。
A.化合反应 b.离子反应 c.氧化还原反应
(3)电解饱和NaCl溶液的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
2NaOH+H2↑+Cl2↑。该反应中氧化产物是___________,每转移0.2mol电子,共产生标准状况下气体的总体积是_____L。
(4)Na2CO3溶液中通入少量HCl,发生反应的离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸钠-过氧化氢加合物(xNa2SO4 ·yH2O2·zH2O)的组成可通过下列实验测定:
①准确称取1.77g样品,配制成100.00mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的氯化钡溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.0025mol。
③准确量取25.00mL溶液A,加入适量的稀硫酸酸化后,用0.02mol·L-1 KMnO4溶液滴定至终点(KMnO4只与加合物中的H2O2发生反应),消耗KMnO4溶液25.00mL。回答下列问题:
(1)在步骤①中,所需玻璃仪器除了烧杯外还需要________________;
(2)在步骤①中,下列操作会使所配溶液浓度偏低的是_______(填字母);
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视仪器上的刻度线
C.定容后震荡摇匀静置,发现液面低于刻度线,于是又加入少量水至刻度线
D.配制前容量瓶中有少量水
(3)③中的KMnO4溶液置于_______(“酸式”或“碱式”)滴定管中,滴定终点的现象是____________________,写出滴定中发生的离子反应方程式_______________;
(4)通过计算确定样品的组成为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图装置进行CO和CO2混合气体的分离和干燥。其中a为弹簧夹(控制气体通过),b为分液漏斗的活塞(该活塞作用是用于控制分液漏斗内液体的流出与否)。

(1)从氢氧化钠、稀硫酸、浓硫酸几种物质中选择合适的物质填入下列空格中,便可达到实验目的,甲瓶内盛________溶液,乙瓶内盛________溶液,分液漏斗内盛________溶液。
(2)实验时先分离出CO,方法是先关闭___(填a或b,下同),打开___,写出此时发生反应的离子方程式:____。
(3)分离完CO后,再收集CO2,方法是先关闭____,再打开____,写出此时产生CO2反应的离子方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1) Ca元素在周期表中位置是____,其原子结构示意图____。
(2) Ca与最活跃的非金属元素A形成化合物D,D的电子式为____,D的沸点比A与Si形成的化合物E的沸点____。
(3)配平用钙线氧脱鳞的化学方程式____:P+FeO+CaO![]() Ca3(PO4)2+Fe。
Ca3(PO4)2+Fe。
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为______;检测Mn+的方法是_____(用离子方程式表达)。
(5)取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在20.00 mL 0.1000 mol·L-1 NH3·H2O溶液中逐滴滴加0.1000 mol·L-1 HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
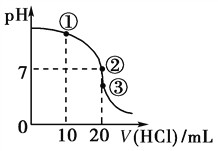
A. ①溶液:c(Cl-)>c(NH)>c(OH-)>c(H+)
B. ②溶液:c(NH)=c(Cl-)>c(OH-)=c(H+)
C. ①、②、③三点所示的溶液中水的电离程度②>③>①
D. 滴定过程中不可能出现:c(NH3·H2O)>c(NH)>c(OH-)>c(Cl-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研制出一种高性能水系酸碱双液锌一溴二次电池,其总反应为:Zn+2OH-+Br3-![]() ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
ZnO+H2O+3Br-,中间的双极性膜(BPM)能隔开酸碱双液且能允许K+通过,如图所示。下列说法正确的是( )
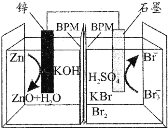
A.放电时,K+向石墨电极迁移
B.放电时,锌电极的电势高于石墨电极
C.充电时,阴极室的pH减小
D.充电时,石墨电极发生反应:Br3--2e-=3Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物是造成大气污染的主要物质。研究氮的化合物的反应机理对于消除环境污染有重要意义。
(1)NO在空气中存在如下反应:2NO(g)+O2(g)![]() 2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:
2NO2(g)△H,上述反应分两步完成,其反应历程如图所示:回答下列问题:

①写出反应I的热化学方程式___。
②对于总反应:2NO(g)+O2(g)![]() 2NO2(g),对该反应体系升高温度发现总反应速率反而变慢,其原因可能是__(反应未使用催化剂)。
2NO2(g),对该反应体系升高温度发现总反应速率反而变慢,其原因可能是__(反应未使用催化剂)。
(2)用焦炭还原NO2的反应为2NO2(g)+2C(s)![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

①A、B两点的浓度平衡常数关系:Kc(A)___Kc(B)(填“<”“>”或“=”)
②A、B、C三点中NO2的转化率最低的是___(填“A”“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=___(Kp是用平衡分压代替平衡浓度计算)
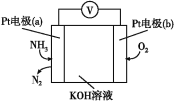
(3)电化学气敏传感器可以监测空气环境中NH3的含量,原理如图所示。负极的电极反应为___,假设有16.8L(标准状况)的氨气进入传感器参与反应,另一极需要通入标准状况下O2的体积为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com