
下列说法正确的是
①pH=2和pH=1的H2SO4中c(H+)之比为1∶10
②0.2mol·L-1与0.1mol·L-1醋酸中,c(H+)之比大于2∶1
③纯水在80℃和20℃时,pH相等
④FeCl3溶液中c(Fe3+)与c(Cl-)之比为1∶3
⑤同温时,pH=10的Ba(OH)2溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100mL 0.1 mol·L-1的醋酸与10 mL 1.0 mol·L-1的醋酸中H+的数目,前者多
| A.①④⑤ | B.①⑤⑥ |
| C.①②⑤ | D.①②③⑥ |
科目:高中化学 来源: 题型:阅读理解
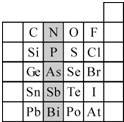 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.

查看答案和解析>>
科目:高中化学 来源: 题型:
 第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:
第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
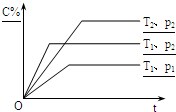 在体积一定的密闭容器中充入物质一定量的A、B、C物质,分别在不同温度或压强条件下发生反应:aA(g)+bB(g)?xC(g),建立的化学平衡符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强).下列说法正确的是( )
在体积一定的密闭容器中充入物质一定量的A、B、C物质,分别在不同温度或压强条件下发生反应:aA(g)+bB(g)?xC(g),建立的化学平衡符合下图所示的关系(c%表示平衡混合气中产物C的百分含量,T表示温度,P表示压强).下列说法正确的是( )| A、a+b<x | B、T1<T2 | C、该反应的正反应是放热反应 | D、P1>P2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com