
| A. | CS2为V形 | B. | HCN为V形 | ||
| C. | NH${\;}_{4}^{+}$为正四面体形 | D. | PCl3为平面三角形 |
分析 根据价层电子对互斥理论确定微粒的空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答.
解答 解:A.CS2分子中价层电子对个数=2+$\frac{1}{2}$×(4-2×2)=2且不含有孤电子对,所以为直线形结构,故A错误;
B.HCN的结构为H-C≡N,C原子的价层电子对数为2,不含有孤电子对,为直线形,故B错误;
C.NH4+中N原子的价层电子对个数=4+$\frac{1}{2}$×(5-1-4×1)=4且不含有孤电子对,所以其空间构型为四面体结构,故C正确;
D.PCl3分子中B原子的价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4且含一个有孤电子对,所以其空间构型为三角锥形,故D错误;
故选C.
点评 本题考查了微粒空间构型的判断,利用价层电子对互斥理论分析解答即可,难点是孤电子对的计算方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
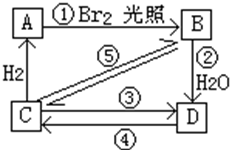 (1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准).| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
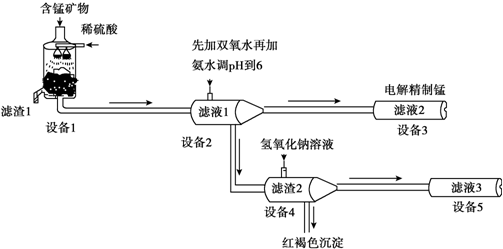
 Al(OH)3
Al(OH)3 AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
AlO2-+H++H2O,加入NaOH溶液,H+被中和,浓度减低,Al(OH)3不断溶解.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
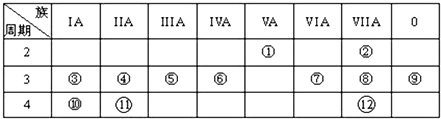
 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式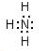 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中不可能含有共价键 | |
| B. | 非金属单质分子中一定存在共价键 | |
| C. | 离子化合物中不一定含有离子键 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
| B | 蒸馏水 | 蔗糖溶液 | 氢氧化钠 | 二氧化碳 |
| C | 小苏打 | 盐酸 | 铁 | 氨气 |
| D | 硫酸 | 食盐水 | 氯化铜 | 纯碱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
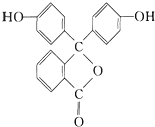
| A. | 酚酞具有弱酸性,且属于芳香族化合物 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 1mol酚酞最多与2molNaOH发生反应 | |
| D. | 酚酞在碱性条件下能够发生水解反应,呈现红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol•L-1HCl溶液 | B. | 1mol•L-1MgCl2溶液 | ||
| C. | 2mol•L-1NaCl溶液 | D. | 1mol•L-1FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com