
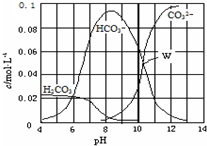
| A. | W点所示的溶液:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) | |
| B. | pH=4的溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol•L-1 | |
| C. | 向pH=8的溶液中通入CO2至pH=7所得的溶液:c(Na+)>c(Cl-)+c(HCO3-)+c(H2CO3) | |
| D. | pH=11的溶液:c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO32-) |
分析 A.根据图知,溶液中存在CO32-、HCO3-且二者的浓度相等,溶液中不存在H2CO3,说明溶液中溶质为碳酸钠、碳酸氢钠,二者都水解导致溶液呈碱性;
B.pH=4时,溶液中不存在CO32-;
C.向pH=8的溶液中通入CO2至pH=7,溶液中c(OH-)=c(H+),溶液中不存在CO32-,根据电荷守恒得c(Na+)=c(Cl-)+c(HCO3-);
D.根据图知,pH=11时溶液中c(H2CO3)=0,溶液中c(Na2CO3)>0.08mol/L,c(NaHCO3)<0.02mol/L,因为反应Na2CO3+HCl=NaHCO3+NaCl,因为碳酸钠水解程度大于碳酸氢钠电离程度,所以得到的溶液中c(NaHCO3)>c(NaCl),则c(Cl-)<c(HCO3-),结合电荷守恒判断.
解答 解:A.根据图知,溶液中存在CO32-、HCO3-且二者的浓度相等,溶液中不存在H2CO3,说明溶液中溶质为碳酸钠、碳酸氢钠,二者都水解导致溶液呈碱性,且其水解程度较小,钠离子不水解,则溶液中存在:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+),故A正确;
B.pH=4时,溶液中不存在CO32-,根据物料守恒得:c(H2CO3)+c(HCO3-)=0.1 mol•L-1,故B错误;
C.向pH=8的溶液中通入CO2至pH=7,溶液中c(OH-)=c(H+),溶液中不存在CO32-,根据电荷守恒得c(Na+)=c(Cl-)+c(HCO3-),所以c(Na+)<c(Cl-)+c(HCO3-)+c(H2CO3),故C错误;
D.根据图知,pH=11时溶液中c(H2CO3)=0,溶液中c(Na2CO3)>0.08mol/L,c(NaHCO3)<0.02mol/L,因为反应Na2CO3+HCl=NaHCO3+NaCl,因为碳酸钠水解程度大于碳酸氢钠电离程度,所以得到的溶液中c(NaHCO3)>c(NaCl),则c(Cl-)<c(HCO3-),溶液呈碱性,结合电荷守恒得c(Na+)>c(Cl-)+2c(CO32-)+c(HCO3-),因为c(Cl-)<c(HCO3-),所以存在c(Na+)+2c(H2CO3)>2c(Cl-)+2c(CO32-),故D正确;
故选AD.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生识图能力及分析判断能力,明确微粒浓度与溶液pH的关系、溶液中存在的电荷守恒是解本题关键,难点是D选项判断,注意等量代换,综合性较强,难度较大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA | |
| B. | 11.2mol•L-1K2S溶液中S2-和HS-的总数为2NA | |
| C. | 300ml2mol•L-1蔗糖溶液中所含分子数为0.6NA | |
| D. | 标准状况下,30g乙酸和甲醛的混合物中氧原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq)$\stackrel{NaOH(aq)}{→}$Fe(OH)2 | |
| B. | Al3+$\stackrel{过量氨水}{→}$Al${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NH3$\stackrel{O_{2}}{→}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| D. | 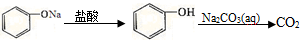 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{22.4}$摩/升 | B. | $\frac{ab}{22400}$摩/升 | ||
| C. | $\frac{ab}{22400+36.5a}$摩/升 | D. | $\frac{1000ab}{22400+36.5a}$摩/升 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 280.58kJ | B. | 562.76kJ | C. | 530.58kJ | D. | 890.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
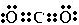 ,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.
,将其转变其他化工原料,必须破坏的化学键属于极性(填“极性”或“非极性”)键.| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
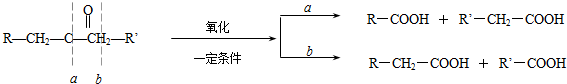
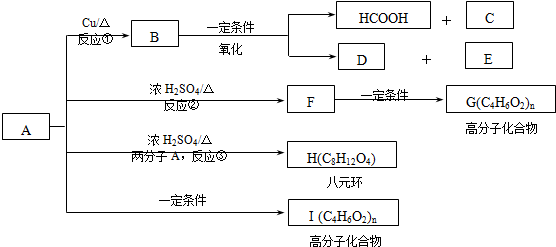
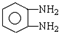 )生成一种合成纤维:
)生成一种合成纤维: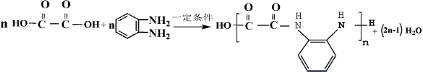 .
.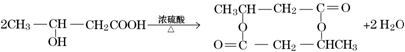 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com