

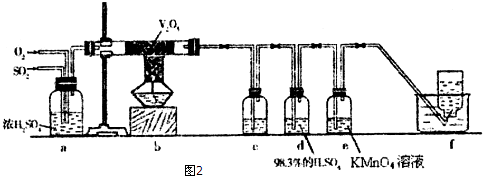
分析 (1)根据仪器的特征和常用仪器的名称进行解答;
(2)装置A:铜和浓硫酸加热反应生成二氧化硫气体,B、C、D分别用于检验SO2的漂白性、还原性和氧化性.其中B装置:检验二氧化硫漂白性可以通过品红试液;C、D分别为碘水和硫化氢的水溶液,C装置:二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢,D装置:二氧化硫具有氧化性,能够与硫化氢反应生成硫单质和水,E为尾气吸收装置;
(3)设计装置F来代替装置A,亚硫酸钠和硫酸反应生成硫酸钠二氧化硫和水,据此书写方程式;
(4)①b装置:二氧化硫和氧气在五氧化二钒的催化作用下,生成三氧化硫;c装置:检验三氧化硫,d装置:吸收三氧化硫除去SO3,e装置:二氧化硫并检验二氧化硫,f装置:
收集氧气,根据c、e中的成分结合实验目的进行解答;
②三氧化硫和水反应生成硫酸,硫酸和亚硫酸钠反应生成二氧化硫,生成的二氧化硫干扰对原混合气体中SO2的检验.
解答 解:(1)仪器G为有玻璃活塞的漏斗,为分液漏斗,
故答案为:分液漏斗;
(2)依据装置图可知,A装置:铜和浓硫酸加热反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,生成二氧化硫气体,B装置:二氧化硫能使品红褪色,说明二氧化硫具有漂白性,C装置:二氧化硫具有还原性,和碘单质反应生成硫酸和碘化氢;反应的离子方程式为:SO2+I2+2H2O═SO42-+2I-+4H+;D装置:二氧化硫具有氧化性,能够与硫化氢反应生成硫单质和水,反应的化学方程式为:SO2+2H2S=3S↓+2H2O,现象为有淡黄色沉淀生成,
故答案为:SO2+I2+2H2O═SO42-+2I-+4H+;有淡黄色沉淀生成;
(3)设计装置F来代替装置A,不用加热,安全性能高,易于控制反应进行,反应更充分,装置F中:亚硫酸钠和硫酸反应,Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑.
故答案为:Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑;
(4)①该实验的目的是检验反应后混合气体的成分,因二氧化硫和氧气反应2SO2+O2$?_{△}^{V_{2}O_{5}}$2SO3是可逆反应,所以从b装置导出的气体是二氧化硫和三氧化硫和氧气,c装置中装有0.5 mol/L BaCl2溶液,三氧化硫和水反应生成硫酸,检验三氧化硫,二氧化硫和和氧气均不与其反应,d装置中装有98.3%的浓 H2SO4,作用是吸收三氧化硫除去SO3,e装置的作用是吸收二氧化硫并检验二氧化硫,品红(或KMnO4溶液)褪色说明有二氧化硫,f收集的是氧气,
故答案为:0.5mol•L-1BaCl2溶液;KMnO4溶液;氧气;
②三氧化硫和水反应生成硫酸,硫酸和亚硫酸氢钠反应2NaHSO3+H2SO4=Na2SO4+H2O+SO2↑,生成的二氧化硫干扰对原混合气体中SO2的检验,
故答案为:否,虽然饱和NaHSO3溶液可除去SO3,但是和水反应生成硫酸,硫酸与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验.
点评 本题考查了二氧化硫化学实验,掌握二氧化硫及其相关化合物的性质结合反应装置的特点分析是解答本题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH3COONa溶液中加入少量KCl固体后的碱性溶液一定有:c(Na+)-c(CH3COO-)=c(OH-)-c(H+) | |
| B. | 同浓度的CH3COONa和NaClO混合液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 常温下,在10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL(忽略溶液体积变化) | |
| D. | 某温度下,pH=11的NH3•H2O和pH=1的盐酸等体积混合后恰好完全反应,反应后的溶液中NH4+、NH3•H2O与NH3三种微粒的平衡浓度之和为0.05 mol•L-1(忽略溶液体积变化) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中只含Fe3+、SO42-、Cl- | |
| B. | 溶液中只含Cu2+、SO42- | |
| C. | 需要利用焰色反应才能确定有无Na+ | |
| D. | 溶液中肯定没有I-但无法确定有无Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+、NH4+、Cl-、CO32- | B. | Na+、CH3COO-、K+、HCO3- | ||
| C. | Fe2+、Cl-、Na+、NO3- | D. | K+、I-、CO3-、Na+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com