
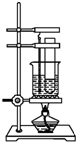
 实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题:
实验室用苯和浓硝酸、浓硫酸发生反应制取硝基苯的装置如图所示.回答下列问题: .
.分析 (1)图中给反应物加热的方法是水浴加热,水浴加热便于控制温度,受热均匀;
(2)配制混合酸时应将浓硫酸加入浓硝酸中,并不断振荡,以防止溅出伤人;
(3)苯与浓硝酸在浓硫酸、加入条件下发生取代反应生成硝基苯与水;
(4)由于苯和硝酸都是易挥发、有毒的物质,设计实验时应考虑它们可能产生的污染和由挥发导致的利用率降低.
解答 解:(1)图中给反应物加热的方法是水溶加热,水域加热便于控制温度,受热均匀,
故答案为:水浴加热;便于控制温度、受热均匀.
(2)配制混合酸时应将密度大的浓硫酸加入到密度小的浓硝酸中去,配制混合酸时应将浓硫酸加入浓硝酸中,并不断振荡,以防止溅出伤人,
故答案为:浓硫酸、浓硝酸;
(3)苯与浓硝酸在浓硫酸、加入条件下发生取代反应生成硝基苯与水,反应方程式为: ,
,
故答案为: .
.
(4)由于苯和硝酸都是易挥发、有毒的物质,应考虑它们可能产生的污染和由挥发导致的利用率降低,装置缺少冷凝回流装置,
故答案为:苯、浓硝酸等挥发到空气中,造成污染.
点评 本题考查硝基苯制备实验的有关判断,该题是基础性试题的考查,试题注重基础,只要是考查学生对硝基苯制备实验的了解掌握程度,以及灵活运用基础知识解决实际问题的能力,有利于培养学生的实验能力,和严禁的逻辑思维能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原单烯烃只可能有3种不同结构 | |
| B. | 该产物的名称是1,1-二甲基丙烷 | |
| C. | 1mol加成产物燃烧消耗6.5mol氧气 | |
| D. | 原烯烃与分子式是C3H6的烃一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述氧化物都是酸性氧化物 | |
| B. | 该反应中NOx用作氧化剂,发生还原反应 | |
| C. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.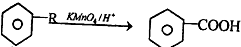
 是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).
是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 该反应属于取代反应 | D. | 氯气的氧化性比溴单质强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com