
分析 纯水存在电离平衡,电离出的氢离子和氢氧根离子浓度相同,水的电离时吸热过程,常温下水电离出氢离子浓度为10-7mol/L.
解答 解:某温度下,纯水中的c(H+)=2.0×10-7mol•L-1,H2O?OH-+H+,则c(OH-)=c(H+)=2.0×10-7mol•L-1,水的电离过程是吸热过程,常温下水电离出的离子浓度c(OH-)=c(H+)=1.0×10-7mol•L-1,所以此时温度高于25℃,
故答案为:2.0×10-7mol•L-1;高于.
点评 本题考查了水的离子积常数的分析应用,水电离平衡分析判断,主要是电离过程是吸热过程,离子积随温度升高增大,题目较简单.


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:解答题
| 时间(s) | 0 | 1 | 2 | 3 | 4 | … |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.00×10-4 | 1.70×10-4 | 1.00×10-4 | 1.00×10-4 | … |
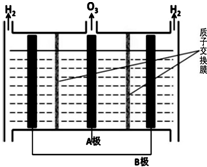
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最后一定有沉淀生成,且有气体放出 | |
| B. | 溶液最后一定澄清,且有气体放出 | |
| C. | 一定有气体放出 | |
| D. | 一定无气体放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在平衡体系PCl3(g)?PCl3+Cl2(g)中加入一定量的${\;}_{\;}^{37}$Cl,达到平衡后”37Cl仅存在于五氯化鱗和氯气分子里,不可能存在于三氯化磷分子 | |
| B. | CH3C00H与H180-CH2CH3;发生酯化反应化是可逆反应,达到平衡后${\;}_{\;}^{18}$0仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里 | |
| C. | CH2Br2没有同分异构体的事实证明了甲烷分子是碳原子为中心的正四面体结构 | |
| D. | 在氧气中完全燃烧后生成物只有C02和H2O的有机物不一定是烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下: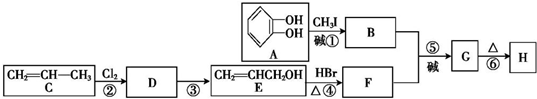
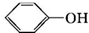 +RX$\stackrel{碱}{→}$
+RX$\stackrel{碱}{→}$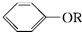 +HX(X代表卤素原子);
+HX(X代表卤素原子);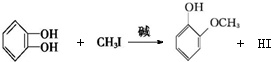 .
.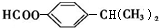 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
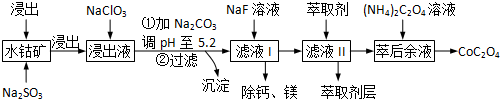
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
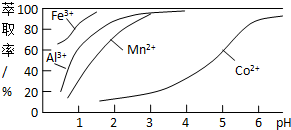
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com