
【题目】对于反应 2NO2(g)![]() N2O4(g) ΔH<0, 增大压强,下列说法正确的是( )
N2O4(g) ΔH<0, 增大压强,下列说法正确的是( )
A. 平衡逆向移动 B. 混合气体颜色比原来深
C. 混合气体颜色比原来浅 D. 混合气体的平均相对分子质量变小
【答案】B
【解析】
对于反应2NO2(g)![]() N2O4(g) ΔH<0,达到平衡后缩小容器体积,增大了压强,平衡向着正向移动,混合气体的总物质的量减小,则混合气体的平均摩尔质量增大;因为缩小容器体积后二氧化氮浓度增大,则混合气体的颜色比原来变深。
N2O4(g) ΔH<0,达到平衡后缩小容器体积,增大了压强,平衡向着正向移动,混合气体的总物质的量减小,则混合气体的平均摩尔质量增大;因为缩小容器体积后二氧化氮浓度增大,则混合气体的颜色比原来变深。
反应2NO2(g)![]() N2O4(g) ΔH<0,反应是气体体积减小的放热反应,达到平衡后缩小容器体积,增大了压强,平衡正向移动,
N2O4(g) ΔH<0,反应是气体体积减小的放热反应,达到平衡后缩小容器体积,增大了压强,平衡正向移动,
A.压强增大,该平衡向着正向进行,故A错误;
B.增大压强,体积迅速减小,平衡移动程度不如体积减小带来的改变大,所以混合气体颜色加深,故B正确;
C.增大压强,体积迅速减小,平衡移动程度不如体积减小带来的改变大,所以混合气体颜色加深,故C错误;
D.增大压强,气体质量不变,物质的量减小,混合气体的平均相对分子质量变大,故D错误;
综上所述,本题选B。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1价和+2价的化合物。
(1)写出基态Cu+的核外电子排布式___________________________________。
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为________。
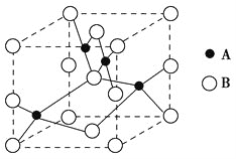
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过________键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是____。与NH3分子互为等电子体的一种微粒是________。
(4)CuO的熔点比CuCl的熔点____(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.5mol N2O4气体通入体积为5L的恒容密闭容器中,立即出现红棕色。反应进行到2秒时,NO2的浓度为0.02 mol/L。在60秒时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2秒,以N2O4的浓度变化表示的平均反应速率为0.01mol/(L·s)
B. 在2秒时体系内的压强为开始时的1.2倍
C. 在平衡时体系内含N2O40.20mol
D. 平衡时,如果再充入一定量N2O4, 则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析化学、医药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是_______(用必要的化学用语和相关文字说明).
(2)相同条件下,0.1mol·L-1的NH4Al(SO4)2溶液中c((NH4+)________(填“等于”、“大于”或“小于”)0.1mol·L-1 NH4HSO4中c((NH4+).
(3)均为0.1mol·L-1的几种电解质溶液的pH随温度变化的曲线如图1所示.

①其中符合0.1mol·L-1 NH4Al(SO4)2的pH随温度变化的曲线是__,导致pH随温度变化的原因是___________________;
②20℃时,0.1mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______.
(4)室温时,向100mL0.1mol·L-1的NH4HSO4溶液中滴加0.1mol·L-1的NaOH溶液,溶液pH与所加NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g)![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v(正)减小③压强增大一倍,平衡不移动,v(正)、v(逆)不变 ④增大B的浓度,v(正)>v(逆) ⑤加入催化剂,B的转化率提高
A. ①② B. ④ C. ③ D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物H (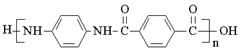 )是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:
)是一种聚酰胺纤维,广泛用于各种刹车片,其合成路线如下:

已知:①C、D、G均为芳香族化合物,分子中均只含两种不同化学环境的氢原子。
②Diels-Alder反应:![]() 。
。
(1)生成A的反应类型是_______。D的名称是_______。F中所含官能团的名称是_______。
(2)B的结构简式是_______;“B→C”的反应中,除C外,另外一种产物是_______。
(3)D+G→H的化学方程式是______。
(4)Q是D的同系物,相对分子质量比D大14,则Q可能的结构有______种,其中核磁共振氢谱有4组峰,且峰面积比为1:2:2:3的结构简式为______(任写一种)。
(5)已知:乙炔与1,3-丁二烯也能发生Diels-Alder反应。请以1,3-丁二烯和乙炔为原料,选用必要的无机试剂合成 ,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
,写出合成路线__________(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应,M、N两种气体的物质的量随时间的变化曲线如图所示:
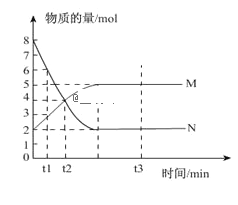
(1)该反应的生成物是___________;
(2)该反应的化学反应方程式为_____________;
(3)到t2时刻,以M的浓度变化表示的平均反应速率为____________;
(4)若达到平衡状态的时间是4 min,N物质在该4 min内的平均反应速率为1.5mol·L-1·min-1,则此容器的容积V=____________L。
(5)达到平衡状态时,反应物的转化率为____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A. 向盐酸中加入氨水至中性,溶液中![]()
B. 在蒸馏水中滴加浓H2SO4,Kw不变
C. 向0.1 mol/L CH3COOH溶液中加入少量水,溶液中![]() 增大
增大
D. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(以下各空用适当的化学用语或关系式填写)密闭容器中mA(g)+nB(g)pC(g),反应达到平衡,经测定增大压强P时,A的转化率随P而变化的曲线如图所示.则:
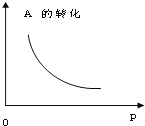
(1)增大压强:A的转化率______,平衡向______ 移动,达到平衡后,混合物中C的质量分数______.
(2)上述化学方程式中的系数m、n、p的正确关系是______.
(3)当降低温度时,C的质量分数增大,则:平衡向______移动,A的转化率______,正反应是______ 热反应.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com