
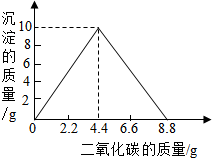
 某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题:
某实验小组在含一定量Ca(OH)2的澄清石灰水中通入CO2,产生沉淀的质量与通入CO2气体的质量的关系如图所示,回答下列问题:分析 (1)OA段表示沉淀量最大,为二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水;
(2)当二氧化碳的质量较少时,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,当二氧化碳的质量过量时,产生的碳酸钙与水和过量的二氧化碳反应,生成可溶性的碳酸氢钙,沉淀消失;
(3)二氧化碳4.4g时,沉淀达到最大,根据CO2+Ca(OH)2=CaCO3↓+H2O计算.
解答 解:(1)从图示可以看出在OA段,二氧化碳与氢氧化钙反应,生成碳酸钙沉淀,到二氧化碳4.4g时,沉淀达到最大,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,
故答案为:CO2+Ca(OH)2=CaCO3↓+H2O;
(2)当二氧化碳的质量较少时,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O,到二氧化碳4.4g时,沉淀达到最大,再继续通二氧化碳,二氧化碳与碳酸钙和水反应,生成可溶性的碳酸氢钙,二氧化碳的量到8.8g时沉淀恰好完全反应,溶液又变澄清,反应的方程式为:CO2+CaCO3+H2O=Ca(HCO3)2,所以
整个实验过程的实验现象:澄清石灰水先变浑浊后变澄清,
故答案为:澄清石灰水先变浑浊后变澄清;
(3)设石灰水中氢氧化钙的质量为X;
CO2+Ca(OH)2=CaCO3↓+H2O
44 74
4.4g X
$\frac{44}{74}$=$\frac{4.4g}{X}$ 解得:X=7.4g,通CO2气体前石灰水中溶质的物质的量为n=$\frac{7.4g}{74g/mol}$=0.1mol,
故答案为:0.1mol.
点评 本题主要考查二氧化碳和氢氧化钙的反应,注意二氧化碳的质量较少时,二氧化碳与氢氧化钙反应生成碳酸钙沉淀,当二氧化碳的质量过量时,产生的碳酸钙与水和过量的二氧化碳反应,生成可溶性的碳酸氢钙为解答关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
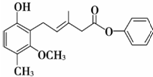
| A. | 该化合物既可以催化加氢,又可以在光照下与Cl2发生取代反应 | |
| B. | 该化合物既可以与溴水反应,又可以使酸性KMnO4溶液褪色 | |
| C. | 该化合物既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2 | |
| D. | 1 mol该化合物最多可以与3mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常见的周期表中,共有七个周期,三个短周期、四个长周期 | |
| B. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行 | |
| C. | 短周期元素,是指一、二、三周期,分别有2、8、8种元素 | |
| D. | ⅠA中的金属元素,称为碱金属元素,ⅦA元素又称为卤族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SO32-的中心原子均为sp3杂化 | |
| B. | ClO3-的空间构型为三角锥形 | |
| C. | 分子晶体的堆积均采取分子密堆积 | |
| D. | CS2为V形的极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
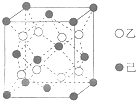 乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.
乙、丙、丁简单离子的核外电子排布相同,这三种元素按6:3:1的原子个数比可形成一种离子晶体W;丙与戊可形成常见离子晶体X,甲与己可形成常见离子晶体Y,且X和Y电子数相同.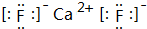 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com