
| A. | 向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O | |
| B. | 将少量SO2气体通入NaClO溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ | |
| C. | Na2CO3溶液中滴加几滴稀盐酸:CO32+H+=HCO3- | |
| D. | NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32- |
分析 A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全,则二者以1:1反应;
B.碱性条件下,溶液中不能大量存在氢离子;
C.碳酸钠与盐酸反应,盐酸少量反应生成氯化钠、碳酸氢钠;
D.氢氧化钙少量,二者反应生成碳酸钙、碳酸钠和水.
解答 解:A.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全,则二者以1:1反应,离子反应方程式为:Ba2++2OH-+H++SO42-+NH4+=BaSO4↓+NH3•H2O+H2O,故A正确;
B.NaClO溶液中通入少量的SO2的离子反应为ClO-+2OH-+SO2═Cl-+SO42-+H2O,故B错误;
C.Na2CO3溶液中滴加几滴稀盐酸,离子方程式:CO32+H+=HCO3-,故C正确;
D.NaHCO3溶液中滴加少量澄清石灰水,离子方程式:2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32-,故D正确;
故选:B.
点评 本题考查了离子方程式的书写,题目难度中等,涉及氧化还原反应、复分解反应,明确反应实质是解题关键,注意离子反应遵循客观事实.


科目:高中化学 来源: 题型:选择题
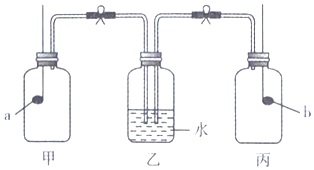
| A. | a为红磷,b为钠 | B. | a为硫,b为木炭 | C. | a为钠,b为红硫 | D. | a为木炭,b为磷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向某无色溶液中滴加氯水和CCl4,振荡、静置,下层溶液显紫色 | 原溶液中有I- |
| B | 向稀HNO3中加入过量的Fe粉,充分反应后,滴入K3[Fe(CN)6]溶液,产生蓝色沉淀 | 稀HNO3将Fe氧化为Fe2+ |
| C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于CH3COOH |
| D | 室温下,用pH试纸测得:0.1mo/L Na2SO3溶液的pH约为10;0.1mol/LNaHSO3溶液的pH约为5. | HSO3-结合H+的能力比 SO32-的强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A、B、C是元素周期表中前18号元素中的3种元素,甲是常见化合物,常温下呈液态,A原子在同周期中半径最小,它们之间存在如图所示关系,下列说法错误的是( )
A、B、C是元素周期表中前18号元素中的3种元素,甲是常见化合物,常温下呈液态,A原子在同周期中半径最小,它们之间存在如图所示关系,下列说法错误的是( )| A. | 原子半径大小:B>A>C | |
| B. | 气态时稳定性:乙>甲 | |
| C. | 与甲含相同元素的另一化合物既有极性键也有非极性键 | |
| D. | 等浓度时,乙的水溶液在A的同主族无氧酸中酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )
已知反应:2SO2(g)+O2(g)?2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( )| A. | 由图甲知,A点SO2的平衡浓度为0.4 mol/L | |
| B. | 由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 | |
| C. | 达平衡后,缩小容器容积,v正和v逆都增大 | |
| D. | 增大SO2浓度,v正增大v逆减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$2Mg+Cl2↑ | B. | Al2O3+3H2=2Al+3H2O | ||
| C. | Fe3O4+4CO$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4CO2 | D. | 2HgO$\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池在充电过程中,阴极得到电子质量增加 | |
| B. | 1 mol羟基含电子数约为7×6.02×1023 | |
| C. | 0.1 mol•L-1 CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值减小 | |
| D. | Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 据2016年11月2日科技日报报道,天宫二号伴随卫星通过7次轨道控制,从天宫二号正上方飞越,并拍摄了多幅照片.拍摄照片的相机包括镜头和CCD(图象传感器)两部 分,其中镜头的材料为玻璃,CCD为半导体材料.下列叙述正确的是( )
据2016年11月2日科技日报报道,天宫二号伴随卫星通过7次轨道控制,从天宫二号正上方飞越,并拍摄了多幅照片.拍摄照片的相机包括镜头和CCD(图象传感器)两部 分,其中镜头的材料为玻璃,CCD为半导体材料.下列叙述正确的是( )| A. | 玻璃和半导体材料均可由SiO2制备 | |
| B. | 普通玻璃的制备原料是纯碱、黏土和石英 | |
| C. | 通讯传输的光导纤维是单晶硅 | |
| D. | 高温下利用氧化剂可使SiO2转化为Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com