
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯。
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,该反应的化学方程式为________________________________________________。
【装置设计】甲、乙、丙三位同学分别设计了如下图所示三套实验装置:
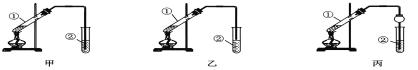
若从甲、乙两位同学设计的装置中选择一套作为实验室制取乙酸乙酯的装置,选择的装置应是__________(选填“甲”或“乙”)。丙同学将甲装置中的玻璃管改成了球形干燥管,除了起冷凝作用外,另一重要作用是__________________________。
【实验步骤】
A.按所选择的装置组装仪器,在试管①中先加入3 mL 95%的乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸。
B.将试管固定在铁架台上。
C.在试管②中加入5 mL饱和Na2CO3溶液。
D.用酒精灯对试管①加热。
E.当观察到试管②中有明显现象时停止实验。
【问题讨论】
(1)步骤A组装好实验装置,加入样品前还应检查______________________。
(2)试管②中观察到的现象是__________________________________________。
(3)试管②中饱和Na2CO3溶液的作用是__________________________________。
饱和Na2CO3溶液________(选填“能”或“不能”)用NaOH溶液代替,其原因是___________。
【答案】【实验原理】CH3CH2OH+CH3COOH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【装置设计】乙 防止倒吸
【问题讨论】(1)装置的气密性
(2)液体分为两层
(3)溶解乙醇,除乙酸、降低乙酸乙酯的溶解度 不能 NaOH与乙酸乙酯反应,促进乙酸乙酯的水解
【解析】
试题分析:乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯的方程式![]() 制取乙酸乙酯要注意防倒吸,选择的装置应是乙;丙同学将甲装置中的 玻璃管改成了球形干燥管,除了起冷凝作用外,另一重要作用是防止倒吸;(1)步骤A组装好实验装置,加入样品前还应检查装置的气密性;(2)乙酸乙酯难溶于饱和碳酸钠溶液,试管②中观察到的现象是液体分为两层;(3)试管②中饱和Na2CO3溶液的作用是溶解乙醇,除乙酸、降低乙酸乙酯的溶解度。
制取乙酸乙酯要注意防倒吸,选择的装置应是乙;丙同学将甲装置中的 玻璃管改成了球形干燥管,除了起冷凝作用外,另一重要作用是防止倒吸;(1)步骤A组装好实验装置,加入样品前还应检查装置的气密性;(2)乙酸乙酯难溶于饱和碳酸钠溶液,试管②中观察到的现象是液体分为两层;(3)试管②中饱和Na2CO3溶液的作用是溶解乙醇,除乙酸、降低乙酸乙酯的溶解度。
饱和Na2CO3溶液不能用NaOH溶液代替,其原因是NaOH与乙酸乙酯反应,促进乙酸乙酯的水解。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.根据对角线规则,铍和铝的性质具有相似性
B.在H3O+、NH4+ 和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.P4和CH4都是正四面体分子且键角都为109o28ˊ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘单质在水溶液中溶解度很小,但在CCl4中溶解度很大,这是因为( )
A.CCl4与I2分子量相差较小,而H2O与I2分子量相差较大
B.CCl4与I2都是直线型分子,而H2O不是直线型分子
C.CCl4和I2都不含氢元素,而H2O中含有氢元素
D.CCl4和I2都是非极性分子,而H2O是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是
A. 在标准状况下,11.2 L H2O中含有的分子数为0.5 NA
B. 32 g O2所含的原子数为2 NA
C. 1 mol/L NaCl溶液中含有的Na+的数为NA
D. 1 mol Na2O2中离子总数为4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为2.0 mol/L的CuSO4溶液。
①配制950 mL 2.0 mol/L的CuSO4溶液应称取胆矾的质量为____ ___g。
②某学生实际配制CuSO4溶液的浓度为1.8 mol/L,原因可能是__ ___。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)写出用上述方法制备CuCl的离子方程式_____ ____。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是 ; _。(回答两点)
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是____ __ ___。
A. 氧化产物是HO2
B. HO2在碱中能稳定存在
C. HO2的电离方程式是HO2![]() H+ + O2-
H+ + O2-
D. 1mol Cu 参加反应有2mol电子发生转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成在制药工业上有着极其重要的地位。现用硝基苯制取苯胺,再用苯胺制得无 色晶体乙酰苯胺(具有退热镇痛作用的药物)。
①化学反应原理为:
![]()
②相关物质的物理常数
物质 | 相对分子质量 | 熔点(℃) | 沸点(℃) | 溶解度(g) | |
水 | 乙醇 | ||||
苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |
③制备乙酰苯胺的装置及过程如下图所示:
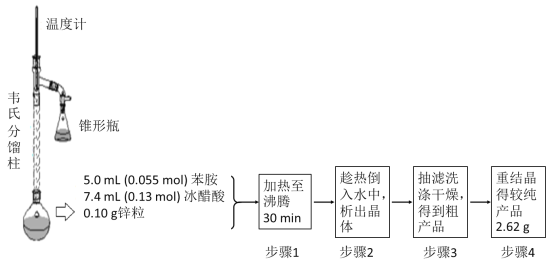
已知:Ⅰ苯胺易被氧化;Ⅱ韦氏分馏柱作用与原理类似于冷凝管
请回答以下问题:
(1)加入锌粒的目的是___________;韦氏分馏柱作用的是_________;
(2)步骤1中保持柱顶温度约为105℃,则锥形瓶中收集到的馏分主要是_____________;
(3)步骤2中将反应液倒入水中的目的是___________;
(4)步骤3中洗涤剂最好选择______________;
A.冷水 B.热水 C.15%的乙醇溶液 D.NaOH溶液
(5)步骤4重结晶的过程:粗产品溶于沸水中配成饱和溶液→再加入少量蒸馏水→加入活性炭脱色→加热煮沸→________→__________→抽滤→洗涤→干燥;
(6)上述制备过程的产率是____________。(结果保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题。
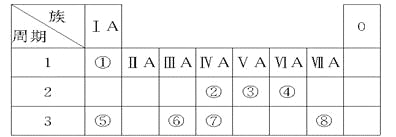
(1) 由②和④组成,造成温室效应的气体的结构式是________
(2) ①、④、⑤、⑧中的某些元素可形成多种既含离子键又含共价键的化合物,写出其中一种化合物的电子式: 。
(3) ④、⑤、⑥的原子半径由大到小的顺序为(填元素符号) 。
(4) ②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是(填化学式) 。
(5)⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下分别将4块形状相同,质量为2.8 g的铁块同时投入到下列四种溶液中,铁块首先完全溶解的是 ( )
A.150 mL 1 mol/L盐酸
B.20 mL 18.4 mol/L硫酸
C.50 mL 3 mol/L盐酸
D.250 mL 2 mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5 g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶于水,制成稀溶液,然后向该溶液中逐滴加入1 mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1) 写出OA段所发生反应的离子方程式_______________。
(2)当加入35 mL盐酸时,产生CO2的体积为___________mL(标准状况)。
(3)原混合物中NaOH的质量为___________g,碳酸钠的质量分数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com