
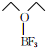 )的熔点为-58℃,沸点为126~129℃,它属于分子晶体.
)的熔点为-58℃,沸点为126~129℃,它属于分子晶体. 分析 (1)原子核外没有运动状态相同的电子;F原子核外电子排布为1s22s22p5,氟原子含有s和p两种类型的轨道;
(2)NaHF2(氟化氢钠)电解可制氟气,说明NaHF2属于离子化合物,F与H原子之间形成共价键,F的电负性较强,还存在氢键;
原子数目相等、价电子总数(或电子总数)相等的微粒互为等电子体;
(3)C2F4分子为F2C=CF2,C原子形成3个σ键、没有孤对电子;
(4)三氟化硼乙醚的熔点、沸点比较低,属于分子晶体.
解答 解:(1)原子核外没有运动状态相同的电子,基态氟原子核外含有9个电子,则其核外电子的运动状态有9种;F原子核外电子排布为1s22s22p5,核外含有s轨道和p轨道两种轨道,则氟原子的电子的电子云形状有2种,氟原子的外围含有7个电子,其外围电子排布式为:2s22p5,
故答案为:9;2;2s22p5;
(2)NaHF2(氟化氢钠)电解可制氟气,说明NaHF2属于离子化合物,F与H原子之间形成共价键,F的电负性较强,还存在氢键;
与HF2-互为等电子体的分子有CO2(或N2O),
故答案为:离子键、共价键、氢键;CO2(或N2O);
(3)C2F4分子为F2C=CF2,C原子形成3个σ键、没有孤对电子,则其杂化轨道类型为sp2,
故答案为:sp2;
(4)三氟化硼乙醚的熔点为-58℃,沸点为126~129℃,其熔沸点比较低,应该属于分子晶体,
故答案为:分子.
点评 本题是对物质结构的考查,涉及核外电子排布、电子云、化学键、等电子体、原子轨道杂化方式及晶体类型与性质等知识,注意掌握原子核外电子排布规律及原子轨道杂化类型的判断方法,(2)中作用力判断为易错点,学生容易忽略氢键.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 用食醋除去暖水瓶中的薄层水垢 | B. | 石油的分馏和煤的干馏 | ||
| C. | 用二氧化氯(ClO2)为自来水消毒 | D. | 液氨作制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,22.4L水所含分子数目为NA | |
| B. | 1mol.L-1 K2SO4溶液所含K+数目为2NA | |
| C. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| D. | O2的摩尔体积约为22.4L.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
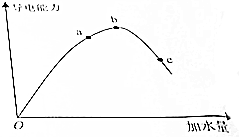 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸中加入过量铁粉:Fe+4H++NO${\;}_{3}^{-}$═Fe3++NO↑+2H2O | |
| B. | 向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全2OH-+Ba2++2H++SO${\;}_{4}^{2-}$═2H2O+BaSO4↓ | |
| C. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO${\;}_{3}^{-}$═3BaSO4↓+2NO↑+H2O | |
| D. | 向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com